
Die gegenüber dem Testosteron stärkere androgene Potenz des Dihydrotestosterons (DHT) wird vielfach mit einer höheren Affinität als der des
Testosterons zum Androgenrezeptor (AR) zu erklären versucht. Doch Assoziations- und Dissoziationskonstanten beider Hormon-Rezeptor-Komplexe sind
unter Berücksichtigung der Stabilität des AR mit und ohne gebundenem Liganden etwa gleich hoch. Andererseits ist die ca. zehnfache Konzentration
an Testosteron erforderlich, um die gleichen transkriptorischen Effekte wie mit DHT zu erzielen. Neueste Untersuchungen lassen darauf schließen,
dass durch die Bindung von Testosteron an der Aktivierungsfunktion 2 weniger günstige Bedingungen für Interaktionen innerhalb des AR und mit
Koaktivatoren geschaffen werden als bei Bindung von DHT [1].
Genomische Wirkungen des Hormon-aktivierten Androgenrezeptors
-
Der Androgenrezeptor ist ein Liganden-aktivierter Transkriptionsfaktor und gehört zur großen Familie der Kernrezeptoren. Solche Rezeptoren
vermitteln so genannte genomische Wirkungen der Steroidhormone, d.h. sie regulieren die Expression entsprechend responsiver Gene. Hierzu wird
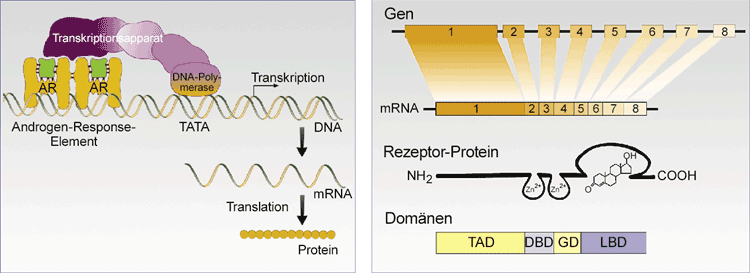
im regulatorischen Abschnitt des entsprechenden Gens ein Transkriptionsapparat ausgebildet (Abb. 1)
. Der Androgenrezeptor unterscheidet sich von den anderen Steroidhormonrezeptoren, indem er durch zwei hochaffine Hormone aktiviert werden kann: Testosteron und Dihydrotestosteron. Das in seiner physiologischen Potenz stärkere DHT ist für die männliche sexuelle Entwicklung essenziell, während Testosteron das wirksame Androgen in der Muskulatur ist und anabole Effekte in der Pubertät hat.
Die molekulare Struktur des AR ähnelt der des Glukokortikoidrezeptors, des Progesteronrezeptors und des Mineralokortikoidrezeptors. Funktionell
lässt sich der AR in Module gliedern: Das N-terminale Ende ist die Transaktivierungsdomäne. Es schließen sich die DNA-Bindungsdomäne und die
Gelenk(hinge)domäne an. Am C-terminalen Ende befindet sich die Ligandenbindungsdomäne (Abb. 2).
| |
| Abb. 1: Androgenrezeptor (AR) als Bestandteil des Transkriptionsapparates: Im regulatorischen Bereich eines Androgen-abhängigen Gens befinden sich Androgen-Response-Elemente, an die sich der dimere, Liganden-aktivierte AR anheftet. Der Transkriptionsapparat enthält neben Basalfaktoren zur Beschleunigung der Transkription auch Kofaktoren. | Abb. 2: Schematische Strukturen des Androgenrezeptor (AR)-Gens, der mRNA, des Rezeptorproteins und der funktionellen Domänen: Das AR-Gen enthält acht Exons. Das große Exon 1 umfasst die Transaktivierungsdomäne (TAD). Exons 2-8 kodieren für die DNA-Bindungsdomäne (DBD), die Gelenkdomäne (GD) und die Ligandenbindungsdomäne (LBD). |
-
Um seine Funktion als Hormon-aktivierter Transkriptionsfaktor erfüllen zu können, muss der Hormon-AR-Komplex über einen längeren Zeitraum stabil
sein. Neben einer hohen Ligand-Rezeptor-Affinität setzt dies eine möglichst lange Verweildauer des Hormons in der Ligandenbindungstasche des Rezeptors
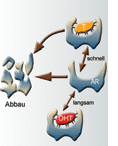
voraus. Testosteron dissoziiert dreimal schneller vom AR als DHT [2].
Auch die Stabilität des Androgenrezeptors selbst spielt eine erhebliche Rolle für die androgene Aktivität. Freie Rezeptoren unterliegen einem
beschleunigten enzymatischen Abbau. Erst wenn die Rezeptoren durch Binden in einer optimalen Konformation fixiert werden, sind sie metabolisch stabil.
Demzufolge schützt DHT den Androgenrezeptor effektiver vor enzymatischer Degradierung als Testosteron (Abb. 3).
|
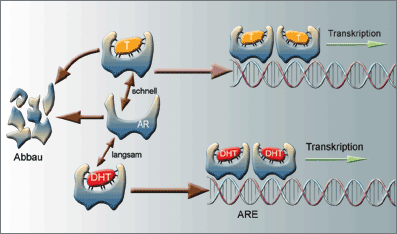
Abb. 3: Der Androgenrezeptor (AR) wird durch verschiedene Liganden in unterschiedlichem Umfang stabilisiert. Testosteron (T)
und Dihydrotestosteron (DHT) haben etwa gleich große Affinitäten zum AR. Doch die Geschwindigkeit der Dissoziation ist beim T ca. dreimal höher
als beim DHT. Durch die größere Wechselrate kann T den AR nicht optimal stabilisieren. Hierdurch ist der AR zudem anfälliger gegenüber Proteasen
und wird rascher abgebaut. ARE = Androgen-Responseelement (nach Zhou Z-x, et al. 1995). |
-
Röntgenstrukturanalysen haben ergeben, dass die Konformationsänderungen im Bereich der Ligandenbindungstasche, die durch Binden von Testosteron
oder DHT hervorgerufen werden, sehr ähnlich sind und keine Erklärung für unterschiedliche Aktivitäten des AR liefern. Die höhere Polarität von
Testosteron führt dazu, dass die hydrophobe Aktivierungsfunktion 2 durch Testosteron weniger stabilisiert wird als mit DHT.
Bei der Induktion mit dem Androgen wird im Bereich der Ligandenbindungsdomäne des AR eine hydrophobe Spalte an der Oberfläche für Interaktionen mit hydrophoben Bindungspartnern zugänglich. Als solche kommen Sequenzen in der N-terminalen Transaktivierungsdomäne des AR und andere Proteine (Koaktivatoren, Korepressoren) in Frage. Erstere Sequenzen haben das FxxLF-Motiv (F = Phenylalanin, L = Leucin, x = beliebige Aminosäure). Hierbei spielt insbesondere FQNLF (Phe-Gln-Asp-Leu-Phe) eine wichtige Rolle.
Die Interaktion der N- mit der C-terminalen Region des AR (N/C-Interaktion) ist für die Transaktivierungsfunktion unentbehrlich. Verschiedene natürlich vorkommende Mutanten des AR, bei denen keine N/C-Interaktion zustande kommt, verursachen Andro-genresistenz, auch wenn die hochaffine Bindung von Testosteron oder DHT nicht beeinträchtigt ist.
Die Aktivierungsfunktion 2 dient insbesondere auch als Bindungsstelle für verschiedene Koaktivatoren, die in ihrer Aminosäurensequenz ein
LxxLL-Motiv besitzen. Mit DHT als AR-Ligand sind hydrophobe Interak-tionen mit FxxLF- und LxxLL-Motiven durch die Möglichkeit der Ausbildung
von Wasser-vermittelten Wasserstoffbrückenbindungen energetisch begünstigt. Diese Stabilisierung trägt wesentlich dazu bei, dass der DHT-AR-Komplex
dreimal langsamer dissoziiert als der Testosteron-AR-Komplex.
[1] Askew EB, Gampe Jr RT, Stanley TB, et al. 2007. Modulation of androgen receptor activation function 2 by testosterone and dihydrotestosterone. J Biol Chem 282:25801-25816.
[2] Zhou Z-x, Lane MV, Kemppainen JA, et al. 1995. Specificity of ligand-dependent androgen receptor stabilization: receptor domain interactions influence ligand dissociation and receptor stability. Mol Endocrinol 9:208-218. J Biol Chem 282:25801-25816.
© 2003-2025 pro-anima medizin medien
–
impressum
–
mediadaten
–
konzeption
–
datenschutz
