
Stand 2006
Botulinumtoxine werden seit 1981 bei unterschiedlichen Indikationen therapeutisch
eingesetzt (Tab. 1). Auch in der Urologie gewinnt ihr Einsatz in der Therapie neurogener und
nicht-
Therapiegrundlagen
-
Botulinumtoxin wird vom grampositiven, stäbchenförmigen, sporenbildenden Bakterium
Clostridium botulinum unter anaeroben Bedingungen produziert. Es stellt das stärkste
bekannte Gift dar. Theoretisch können mit 1 mg des Toxins bis zu 10.000 Menschen getötet werden.
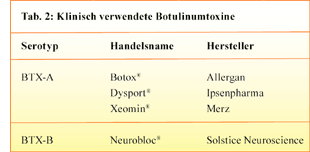
Insgesamt sind sieben immunologisch unterschiedliche Serotypen des Botulinumtoxins bekannt
(BTX-A/B/C/D/E/F/G), von denen sich aber nur BTX-A und BTX-B in breiter klinischer Anwendung
befinden (Tab. 2).
Das eigentliche Botulinumprotein besteht aus einer schweren Kette (ca. 100 kD) und einer
leichten Kette (ca. 50 kD), die von Hüllproteinen umgeben sind. Das Toxin bindet über die

Die biologische Aktivität des Botulinumtoxins wird in sog. Mouse Units (MU) angegeben. Dabei entspricht 1 MU der Toxinmenge, die nach intraperitonealer Gabe bei 50% der Mäuse zum Tode führen würde (= LD50). Die MU der verschiedenen BTX-Serotypen unterscheiden sich bei den kommerziell erhältlichen Präparaten. Ein Umrechnungsfaktor wurde bisher nur für die zervikale
Im Tiermodell diffundiert BTX-A nach intramuskulärer Injektion von 10 MU/0,1 ml bis zu 4,5 cm weit. Der biologische Effekt nimmt abhängig von der injizierten Menge vom Injektionsort zur Peripherie hin ab. Faszien stellen mechanische Barrieren dar, die die Diffusion des Toxins erheblich behindern können (zu beachten bei der Injektion in eine fibrotisch veränderte Harnblasenwand!).
Nach einigen Monaten wird das Toxin proteolytisch inaktiviert; es kommt zur Bildung von neuen
Fusionsproteinen, und die Synapse wird wieder funktionstüchtig. Parallel dazu erfolgt in quergestreifter
Skelettmuskulatur eine Reinnervation der gestörten neuromuskulären Übertragung durch Aussprossung
(sprouting) neuer terminaler Nervenendigungen. Ein solches Sprouting konnte bisher in der glatten
Harnblasenmuskulatur nicht nachgewiesen werden [1].
-
Das Wirkprinzip einer präsynaptischen Blockierung im Bereich der cholinergen neuromuskulären
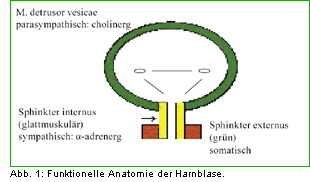
Die physiologische Harnblasenfüllung und Harnblasenentleerung unterliegen einem komplexen
Zusammenspiel sympathischer, parasympathischer und somatischer Regelkreisläufe, deren Endstrecke
vereinfacht dargestellt im Bereich der Harnblase der parasympathisch cholinerg innervierte Musculus
detrusor vesicae, der alpha-adrenerg innervierte Blasenhals und der cholinerg innervierte
Sphinkter-
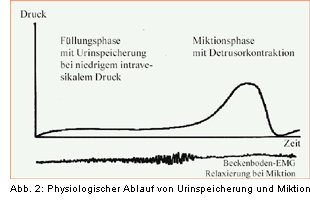
Nur das korrekte Zusammenspiel von M. detrusor vesicae und internem bzw. äußerem Schließmuskelsystem
ermöglicht eine korrekte physiologische Urinspeicherung bei niedrigen intravesikalen Drücken und
eine Miktion mit Detrusorkontraktion und gleichzeitiger Relaxierung des Beckenbodens (Abb. 2).
Klinisch bedeutsame Störungen in diesem Zusammenspiel sind die Detrusor overactivity und das Dysfunctional
-
Kommt es während der Miktionsphase nicht zur Entspannung des Beckenbodens, so resultiert daraus eine
subvesikale Obstruktion. Bei neurogenem Grundleiden wird dies bei Steigerung der Beckenbodenaktivität
während der Miktion als Detrusor-
Das klinische Bild des Dysfunctional voiding ist durch einen abgeschwächten, stakkatoförmigen Harnstrahl und durch Restharnbildung charakterisiert. Insbesondere die Restharnbildung führt zu weiteren klinischen Symptomen wie Harnweginfekten und in schweren Fällen zur konsekutiven Schädigung des oberen Harntraktes mit vesikorenalem Reflux, Stauungsnieren, Pyelonephritiden bis hin zu bleibenden Nierenschäden. Das therapeutische

-
Die Detrusorüberaktivität ist durch vorzeitige, unwillkürliche Detrusorkontraktionen definiert.
Die Detrusorüberaktivität kann
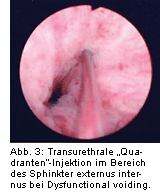
Das therapeutische Spektrum umfasst die anticholinerge orale Medikation mit tertiären (z.B. Oxybutynin, Flavoxat, Propiverin) oder quartären (Trospiumchlorid) Aminen, die sakrale Neuromodulation bzw. sakrale Deafferentation (bei komplettem Querschnitt), die Blasen(auto)augmentation und die Harnblasenersatzplastik (wenn die Urethra für die Miktion oder für einen intermittierenden Einmalkatheterismus nicht benutzbar ist).
Bei der Detrusorüberaktivität kann die Blockierung der Detrusormuskulatur durch die transurethrale Injektion von Botulinumtoxin ein Therapieansatz bei Versagen der oralen Therapie sein, bevor Maßnahmen wie die Blasenaugmentation oder die Blasenersatzplastik durchgeführt werden müssen. Hierbei wird in Abhängigkeit vom gewählten Präparat die Toxinmenge mittels einer konventionellen
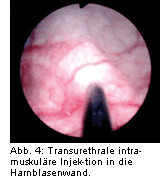
Abb. 4). Die Ureterostien und das Trigonum bleiben dabei ausgespart, um den physiologischen vesikoureteralen Verschlussmechanismus und die physiologische Öffnung des Harnblasenhalses bei der Miktionseinleitung nicht zu beeinträchtigen.
Überwiegend findet in der Urologie das BTX-A-Präparat Botox® Verwendung. Nur vereinzelt
sind Studienergebnisse mit Dysport® publiziert. Für Xeomin® wurden bisher keine Studienergebnisse
zum Einsatz bei Harnblasenfunktionsstörungen veröffentlicht. BTX-B (Neurobloc®) findet gelegentlich
bei BTX-A-resistenten Blasenfunktionsstörungen Anwendung [2]. Die therapeutische Effizienz
der Botulinumtoxin-B-Injektion ist durch eine Doppelblindstudie belegt [3].
-
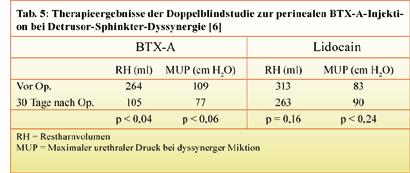
Sowohl für die Detrusor-Sphinkter-Dyssynergie bzw. für das Dysfunctional voiding wie auch für die
neurogene und idiopathische

-
In dieser Indikation wurde Botulinumtoxin ursprünglich zum ersten Mal im Bereich der Urologie
eingesetzt [4]. Es handelte sich um die perineale Injektion von BTX-A bei
querschnittgelähmten Patienten mit hohem Querschnitt und dyssynergem Miktionsverhalten, bei denen
ein Einmalkatheterismus nicht möglich war. Durch die BTX-A-Injektion kam es zu einer signifikanten
Abnahme der Restharnmenge bei gleichzeitiger Reduktion des Urethraldruckes. Schurch et al. untersuchten
die periurethrale und die perineale Injektion von 100 MU Botox® bzw. 250 MU Dysport® und fanden
dabei – gemessen am urethralen Verschlussdruck während der dyssynergen Miktion – Vorteile für die
transurethrale Injektionstechnik (Reduktion des urethralen Verschlussdruckes um ca. 50% bei
transurethraler Injektion und von ca. 40% bei perinealer Injektion)
-
Die Therapieerfahrungen aus der Behandlung der Detrusor-Sphinkter-Dyssynergie wurden von einer Reihe
von Untersuchern auch auf das nicht-neurogene Dysfunctional voiding übertragen. Die Datenlage ist dabei
unübersichtlich, da in diese Patientenkollektive zum Teil Patienten mit neurogenen Grund- oder
Begleiterkrankungen wie Multiple Sklerose und periphere Neuropathien mit aufgenommen und diese Patienten
lediglich von der klassischen Indikation bei querschnittgelähmten Patienten mit dyssynergem Miktionsverhalten
abgegrenzt wurden. Innerhalb dieser Kollektive sind dann Patienten mit nicht-neurogenem Dysfunctional voiding
oft nicht weiter aufgeschlüsselt. Insgesamt zeigen aber die Untersuchungen, so zum Beispiel Kuo im bisher
größten publizierten Krankengut mit 103 Patienten, den Effekt der transurethralen Botulinum-
Für Kinder mit Dysfunctional voiding existiert bisher nur der Fallbericht eines siebenjährigen Mädchens,
das bei rezidivierenden Harnweginfekten und Enuresis bei Detrusor overactivity und Dysfunctional voiding
nach frustanen verhaltenstherapeutischen und medikamentösen Therapieversuchen mittels periurethraler
Botulinum-
-
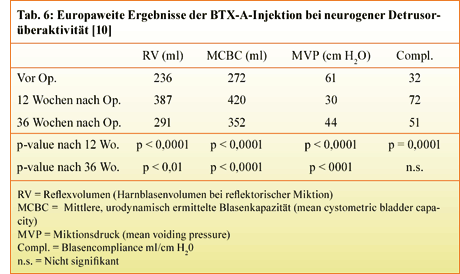
Die neurogene Detrusorüberaktivität stellt nach der Erstpublikation von Stöhrer et al. (1999) heute
sicherlich die häufigste Indikation zur Botulinum-Therapie dar [9]. Es wurde in der Zwischenzeit eine
Reihe von Studien publiziert, die den therapeutischen Benefit der Botulinum-Injektion zeigen. Exemplarisch
seien die Therapieergebnisse an 200 Patienten (davon 167 Patienten mit Querschnittverletzung) dargestellt,
die an verschiedenen europäischen Zentren behandelt wurden [10] (Tab. 6).
Bei diesen Patienten konnte nach Injektion
von 300 MU BTX-A im Durchschnitt eine Erhöhung des Harnblasenvolumens von 272 auf 420 ml bei gleichzeitiger
Zunahme des Restharnvolumens von 236 auf 387 ml erreicht werden. 132 der 180 inkontinenten Patienten waren
nach BTX-A-
Für den Einsatz von Botulinum-toxin bei neurogener Detrusor overactivity im Kindesalter liegen limitierte Beobachtungen vor. Es handelt sich dabei in der Regel um Kinder mit Meningomyelozele und neurogener Detrusorüberaktivität, die auf die konventionelle Therapie mit oralen Anticholinergika mit und ohne begleitenden intermittierenden Einmalkatheterismus nicht ansprachen. Schulte-Baukloh et al. [11] und Riccabona et al. [12] berichten über 20 bzw. 15 Kinder mit neurogener Detrusorüberaktivität bei Meningomyelozele und erfolgloser konservativer Therapie. Nach transurethraler intramuskulärer Injektion von 10 bzw. 1 2 MU BTX-A/kg KG vergrößerte sich das durchschnittliche Reflexvolumen
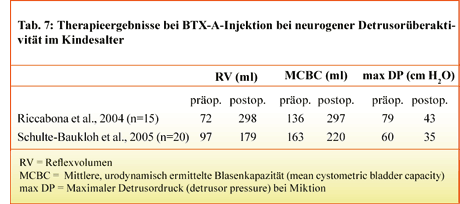
(Tab. 7). Bei gleichzeitigem intermittierendem Einmalkatheterismus wurden 13 von 15 Kindern kontinent [12]. Der Effekt der Injektion hielt ca. sechs Monate vor. Bei wiederholten Injektionen waren die urodynamisch messbaren Verbesserungen auch nach fünf Injektionen mit der Erstinjektion vergleichbar, so dass der Therapieeffekt auch bei mehrfacher Injektion nicht verloren ging [13].
-
Analog zur neurogenen Detrusorüberaktivität wurde BTX-A auch mit Erfolg bei nicht-neurogener Detrusorüberaktivität
eingesetzt. Kuo berichtet über 20 Patienten mit Dranginkontinenz, von denen neun Patienten nach Injektion von
200 MU BTX-A wieder kontinent waren, acht Patienten eine Besserung verspürten und nur drei Patienten ohne
therapeutischen Benefit blieben. Bemerkenswert ist, dass bei sechs Patienten wegen großer Restharnmengen der
intermittierende Einmalkatheterismus notwendig wurde, und dass 15 von 20 Patienten über eine verzögerte und
erschwerte Miktionseinleitung berichteten. Der Effekt der BTX-Injektion war urodynamisch über einen Zeitraum
von über sechs Monaten nachweisbar [14]. Werner et al. injizierten bei 26 Frauen mit Dranginkontinenz
100 MU BTX-A in den M. detrusor [15]. Bei den Kontrolluntersuchungen waren nach vier Wochen 14 von 26 Frauen,
nach zwölf Wochen 13 von 20 Frauen und nach 36 Wochen drei von fünf Frauen kontinent. Bei zwei Frauen wurde ein
vorübergehender Einmalkatheterismus notwendig. Flynn et al. konnten bei schwerer Dranginkontinenz bei 20 Frauen
eine Reduktion der täglichen Inkontinenzepisoden von durchschnittlich 7/Tag auf 1,66/Tag nach drei Monaten
erreichen; danach nahm die Zahl der Inkontinenzepisoden wieder auf 4/Tag zu, so dass in dieser Arbeit der
Therapieeffekt über drei Monate nachweisbar war [16].
Interstitielle Zystitis
-
BTX-A wurde bei Patienten mit klinisch gesicherter interstitieller Zystitis eingesetzt.
Im Gegensatz zur Detrusorüberaktivität erfolgte in den vorliegenden Untersuchungen die
BTX-A-Injektion in das Trigonum und in den Blasenboden, um die hier vorliegende dichte
sensorische Innervation zu treffen, ohne gleichzeitig die Blasenentleerung durch eine
chemische Denervierung der Detrusormuskulatur zu beeinträchtigen. Für die in den Arbeiten
postulierte Wirkung von Botulinum auf sensorische Nervenfasern gibt es aber zurzeit keine
experimentell abgesicherten pathophysiologischen Grundlagen. Smith et al. berichten über
einen deutlichen Therapieeffekt bei 13 Patienten mit interstitieller Zystitis nach
BTX-A-
-
Erste limitierte Anwendungsbeobachtung bei schlaffer Blase (Detrusor underactivity) oder
subvesikaler Obstruktion sind beschrieben [20, 21]. Diese letztendlich bisherigen
Einzellfallberichte bedürfen aber der weiteren Überprüfung in größeren Untersuchungsserien.
-
Sowohl für BTX-A wie auch für BTX-B konnte durch Studien der therapeutische Benefit bei
Detrusor-
Literatur:
[1] Haferkamp A, Schurch B, Reitz A, et al. 2004. Lack of ultrastructural detrusor changes following endoscopic injection of botulinum toxin type a in overactive neurogenic bladder. Eur Urol 46:784-791.
[2] Reitz A, Schurch B. 2004. Botulinum toxin type B injection for management of type A resistant neurogenic detrusor overactivity. J Urol 171:804-805.
[3] Ghei M, Maraj BH, Miller R, et al. 2005. Effects of botulinum toxin B on refractory detrusor overactivity: a randomized, double-blind, placebo controlled, crossover trial. J Urol 174:1873-1877.
[4] Dykstra DD, Sidi AA, Scott AB, et al. 1988. Effects of botulinum A toxin on detrusor-sphincter-dyssynergia in spinal cord injury patients. J Urol 139:919-922.
[5] Schurch B, Hauri D, Rodic B, et al. 1996. Botulinum-toxine A as a treatment of detrusor-sphincter-dyssynergia: a prospective study in 24 spinal cord injury patients. J Urol 155: 1023-1029.
[6] De Sèze M, Petit H, Gallien P, et al. 2002. Botulinum A toxine and detrusor sphincter dyssynergia: a double-blind lidocain controlled study in 13 patients with spinal cord disease. Eur Urol 42:56-62.
[7] Kuo HC. 2003. Botulinum A toxin urethral injection for the treatment of lower urinary tract dysfunction. J Urol 170:1908-1912.
[8] Steinhardt GF, Naseer S, Cruz OA. 1997. Botulinum toxin: a novel treatment for dramatic urethral dilatation associated with dysfunctional voiding. J Urol 158:190-191.
[9] Stöhrer M, Schurch B, Kramer G, et al. 1999. Botulinum toxin in the treatment of detrusor hyperreflexia in spinal cord injured patients: A new alternative to medical and surgical procedures? Neurourol Urodyn 18:401-402.
[10] Reitz A, Stöhrer M, Kramer G, et al. 2004. European experience of 200 cases treated with botulinum-A toxin injections into the detrusor muscle for urinary incontinence due to neurogenic detrusor overactivity. Eur Urol 45:510-515.
[11] Schulte-Baukloh H, Michael T, Sturze-becher B, Knispel H. 2003. Botulinum-A toxin detrusor injection as a novel approach in the treatment of bladder spasticity in children with neurogenic bladder. Eur Urol 44:139-143.
[12] Riccabona M, Koen M, Schindler M, et al. 2004. Botulinum-A toxin injection into the detrusor: a safe alternative in the treatment of children with myelomeningocele with detrusor hyperreflexia. J Urol 171:845-848.
[13] Schulte-Baukloh H, Knispel H, Stolze T, et al. 2005. Repeated botulinum-A toxin injections in treatment of children with neurogenic detrusor overactivity. Urology 66:865-870.
[14] Kuo HC. 2005. Clinical effects of sub-urothelial injection of botulinum A toxin on patients with nonneurogenic detrusor over-activity refractory to anticholinergics. Urology 66:82-87.
[15] Werner M, Schmid DM, Schussler B. 2005. Efficacy of botulinum-A toxin in the treatment of detrusor overactivity incontinence: a prospective nonrandomized study. Am J Obstet Gynecol 192:1735-1740.
[16] Flynn MK, Webster GD, Amundsen CL. 2004. The effect of botulinum-A toxin on patients with severe urge urinary incontinence. J Urol 172:2316-2320.
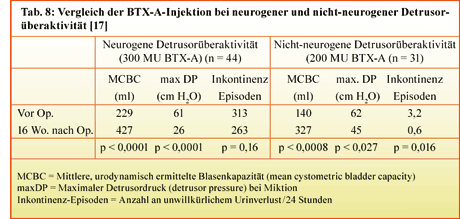
[17] Popat R, Apostolidis A, Kalsi V, et al. 2005. A comparison between the response of patients with idiopathic detrusor overactivity and neurogenic detrusor overactivity to the first intradetrusor injection of botulinum-A toxin. J Urol 174:984-989.
[18] Smith CP, Radziszwewski P, Borkowski A, et al. 2004. Botulinum toxin A has anti-nociceptive effects in treating interstitial cystitis. Urology 64:871-875.
[19] Kuo HC. 2005. Preliminary results of suburothelial injection of botulinum a toxin in the treatment of chronic interstitial cystitis. Urol Int 75:170-174.
[20] Kuo HC. 2003. Effect of botulinum a toxin in the treatment of voiding dysfunction due to detrusor underactivity. Urology 61:550-554.
[21] Kuo HC. 2005. Prostate botulinum A toxin injection – an alternative treatment for benign prostatic obstruction in poor surgical candidates. Urology 65:670-674.
© 2003-2025 pro-anima medizin medien
–
impressum
–
mediadaten
–
konzeption
–
datenschutz
