
Erst- und Zweitlinientherapien bei fortgeschrittenem Blasenkrebs
In der Therapie des muskelinvasiven Urothelkarzinoms (pT2a bis pT4b) werden neben der radikalen
Zystektomie als Standard vielfach auch adjuvante und palliative Chemotherapien eingesetzt. Doch auch
wenn sich das Urothelkarzinom als chemosensitiv erweist, kommt es typischerweise nur zu einem
vorübergehenden Ansprechen. Die Überlebenszeit beträgt zwischen 12 und 14 Monaten. In den letzten
Jahren sind im Bereich der palliativen systemischen Chemotherapie des fortgeschrittenen/metastasierten
Urothelkarzinoms der Harnblase insbesondere der Zweitlinientherapie neue Therapieoptionen hinzugekommen.
Darüber hinaus spielt unter Umständen demnächst die Entwicklung der zielgerichteten „targeted“ Therapien
auch beim Urothelkarzinom eine Rolle.
-
Auch wenn Blasenkrebs bei der überwiegenden Mehrheit der Betroffenen im nicht-muskel-invasiven Stadium
diagnostiziert wird, kommt es auch in 20% bis 50% dieser Fälle letztendlich zum Fortschreiten der Krankheit
bis hin zur metastasierten Situation. Die Behandlung des muskelinvasiven Urothelkarzinoms orientiert
sich hauptsächlich an Faktoren wie Tumorstadium, Differenzierungsgrad, Alter, Allgemeinzustand und
Komorbiditäten. Trotz aller multimodaler Therapieansätze. die sich in den letzten Jahren in den Vordergrund
gedrängt haben, wird die radikale Zystektomie in den EAU-Richtlinien bei lokalisiertem muskelinvasivem
Blasenkrebs nach wie vor als Standardtherapie empfohlen [1].
Radikale Zystektomie
Die vollständige Resektion der Harnblase gilt als ein mit hoher Morbidität (15% bis 40%) und Mortalität
(1% bis 4%) behafteter Eingriff. In einer aktuellen Publikation berichten Hautmann et al. (2010) über die
90-Tage-Komplikationsrate bei mehr als 1.000 ilealen Neoblasen am Klinikum Kassel [2].
Die Autoren betonen, dass die radikale Zystektomie mit Bildung einer ilealen Neoblase einen größeren
Eingriff darstellt, bei dem auch beim erfahrensten Operateur das Risiko relevanter früher Komplikationen
besteht. Die 90-Tage-Mortalitätsrate betrug 2,3%. Bei 36% der Patienten traten weniger schwere
(Grad 1/2) und bei 22% der Patienten schwere (Grad 3-5) Komplikationen auf.
Strahlentherapie
In den EAU Richtlinien für muskelinvasiven und metastasierten Blasenkrebs wird die Bestrahlung als
Monotherapie als primäre kurative Option nicht empfohlen [1]. Allerdings spielt die
Strahlentherapie in multimodalen Behandlungskonzepten bei ausgewählten Patienten, für die eine Zystektomie
aus verschiedenen Gründen nicht in Betracht kommt, eine gewisse Rolle.
Monostrahlentherapie bei muskelinvasivem Blasenkrebs
Fünfundsiebzig Patienten mit muskelinvasivem Blasenkrebs (mittleres Alter: 74,2 Jahre), die für eine
radikale Zystektomie nicht geeignet waren, erhielten eine externe Strahlentherapie. In allen Fällen war
zuvor eine transurethrale Tumorresektion vorgenommen wurden, die bei 62 Patienten makroskopisch unvollständig
war. Ein Komplettansprechen wurde bei 65% der Patienten beobachtet. Die lokale Kontrolle über drei Jahre
wurde in 52,5% der Fälle erreicht, und die metastasenfreie Überlebensrate betrug 63,7% – bei den
Patienten mit Komplettansprechen sogar 71%. Als prognostische Faktoren für Krankheitsprogression
wurden Hydronephrosis, Lymphgefäßinvasion und makroskopischer Residualtumor ermittelt. Erstere beide
Risikofaktoren standen auch im Zusammenhang mit einem erhöhten Lokalrezidivrisiko [3].
-
Bei fortgeschrittenem/metastasiertem Urothelkarzinom der Harnblase sind platinhaltige Schemata Standard.
Diesbezüglich hat sich in den letzten Jahren bei der systemischen Erstlinien-Chemotherapie die Zweierkombination
Gemcitabin/Cisplatin gegenüber der lange Zeit als Therapie der Wahl geltenden Kombinationstherapie mit
Methotrexat, Vinblastin, Adriamycin und Cisplatin (MVAC) durchgesetzt. In einer Phase-III-Vergleichsstudie
betrugen das mediane Gesamtüberleben 14,0 Monate bzw. 15,2 Monate und das progressionsfreie Überleben 7,7 Monate
bzw. 8,3 Monate [4]. Die Präferenz für die Zweierkombination Gemcitabin/Cisplatin bei ähnlichen Überlebensraten
begründet sich im Wesentlichen auf die geringere Nebenwirkungsrate gegenüber der Therapie mit MVAC. Auch
die Erweiterung zur Dreierkombination Gemcitabin, Cisplatin plus Paclitaxel resultierte nicht in der
angestrebten statistisch signifikanten Verlängerung des Gesamtüberlebens, so dass der deutlich geringere
Prozentsatz an schweren und schwersten Nebenwirkungen für die Beibehaltung von Gemcitabin plus Cisplatin
als First-line-Standardtherapie beim metastasierten Urothelkarzinom der Harnblase spricht.
Die zytotoxische Wirksamkeit verschiedener herkömmlicher Chemotherapeutika lässt sich durch Zugabe von 1,25-Dihydroxyvitamin D3 (1,25D3) potenzieren. Anhand von In-vitro- und In-vivo-Blasenkrebs-Modellen ließ sich das auch für die Kombination Gemcitabin/Cisplatin nachweisen. In Verbindung mit 1,25D3 werden die Expression von p73 und eine erhöhte Apoptoserate induziert [5].
Eine Untersuchung der Wirkung von Gemcitabin und Cisplatin auf den Apoptoseindex und die Zellzykluskinetik verschiedener Urothelkarzinom-Zelllinien mit Wildtyp- oder mutiertem p53 zeigten zwar beide Substanzen eine Erhöhung der Apoptoserate, doch die Überlebensraten waren bei der Kombination beider Agentien unabhängig vom p53-Status deutlich geringer. Sowohl mit Gemcitabin alleine als auch mit der Kombination kam es zu einem G1-Zellzyklus-Arrest [6]. Auch unter den neuen Kombinationen beträgt das durchschnittliche Überleben bei fortgeschrittenem/metastasierten Urothelkarzinom der Harnblase nur 14 bis 16 Monate. Die Mehrheit der Patienten benötigt eine Zweitlinientherapie.
-
Vorbehandelte Urothelkarzinom-Patienten, die nach der Erstlinientherapie ein Rezidiv erleiden,
befinden sich vielfach in einem schlechten Allgemeinzustand. Ihr Metastasierungsstatus, eingeschränkte
Organfunktionen und Schmerzen erfordern bei der Zweitlinien-Chemotherapie besondere Berücksichtigung.
Deren Anforderungen erstrecken sich daher nicht nur auf eine nachgewiesene Lebensverlängerung, sondern
es soll insbesondere auch Lebensqualität bei erträglichen tumorbedingten Beschwerden bewahrt werden.
Vinflunin bei fortgeschrittenem Cisplatin-vorbehandeltem Urothelkarzinom
In einer Phase-III-Studie erhielten Patienten mit histologisch nachgewiesenem rezidiviertem
Übergangszellkarzinom der Harnblase (Stadium Ta und T1 aller Grade) randomisiert entweder Vinflunin
zusammen mit maximaler Supportivtherapie (best supportive care, BSC) oder alleine die BSC. Für Vinflunin
plus BSC ergab sich gegenüber alleiniger BSC ein signifikanter Überlebensvorteil von 2,6 Monaten (Abb. 1).
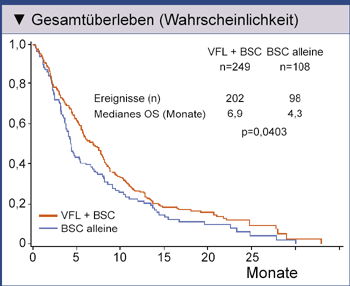
|
Abb. 1: Gesamtüberleben (OS) der Patienten ohne Verletzung wesentlicher Einschlusskriterien „eligible population“ (n=357; 96,5% der intention-to-treat population). VFL=Vinflunin; BSC=best supportive care [7]. |
Vinflunin ist der erste Vertreter einer neuen Klasse bifluorierter Mikrotubuli-Inhibitoren. Der Wirkstoff zeigte in der präklinischen Prüfung eine im Vergleich zu anderen Mikrotubuli-Inhibitoren geringere Affinität zu Tubulin, die aber invers mit der antitumoralen Aktivität korreliert zu sein scheint.Schwerwiegende (Grad 3 und 4) behandlungsbezogene Toxizitäten waren unter Vinflunin plus BSC häufiger als mit BSC alleine. Sie betrafen insbesondere Neutropenien, die allerdings reversibel waren und nur in zwei Fällen zum Therapieabbruch führten [7].
Von der European Association of Urology (EAU) wurde Vinflunin (Javlor®) in die Leitlinien
aufgenommen. Vinflunin ist somit neuer Standard und derzeit die einzige zugelassene Therapie für das
fortgeschrittene/metastasierte Urothelkarzinom nach Versagen einer Cisplatin-
Prognostische Faktoren nach Versagen einer Platin-haltigen Therapie
In einer Kohorte A wurden 50 mg/d Sunitinib für vier Wochen gegeben und nachfolgend zweiwöchig mit der
Einnahme pausiert. In Kohorte B wurden 37,5 mg/d Sunitinib kontinuierlich dosiert. Bei 29% der Patienten
blieb die Krankheit für mehr als drei Monate stabil. Toxizitäten Grad 3 oder 4 – vorwiegend Lymphopenie,
Thrombozytopenie, Anämie, Nausea und Fatigue – traten bei 57 Patienten (33 in A und 24 in B) auf. Eine
Patientin starb im Zusammenhang mit der Therapie. Trotz des beobachteten antitumoralen Ansprechens unter
Sunitinib wurde der im Voraus festgelegte Schwellenwert einer 20 %igen Aktivität nicht erreicht [10].
Vor Therapiebeginn waren in der Vinflunin-Phase-III-Studie eine Reihe von klinischen und Laborparametern
ermittelt worden, die möglicherweise als prognostische Faktoren für das Gesamtüberleben bei Patienten mit
metastasiertem Übergangszellkarzinom nach Versagen einer platinhaltigen Erstlinientherapie herangezogen
werden können. Validiert wurden diese Daten anhand der Ergebnisse einer großen Phase-II-Studie zu Vinflunin
mit etwa gleicher Patientenklientel [8]. Hierbei erwiesen sich ein Performance-Status >0, ein
Hämoglobin-Wert unter 10 g/dl und das Vorhandensein von Metastasen in der Leber als hauptsächliche
ungünstige Prognosefaktoren. Wurden die Patienten der Phase-III- und Phase-II-Studie jeweils gesondert
nach der Zahl vorliegender Risikofaktoren analysiert, ergaben sich Gesamtüberlebenszeiten von 14,2, 7,3,
3,8 und 1,7 Monaten (Abb. 2) bzw. 11,5, 7,3, 3,8 und 2,4 Monaten [9].
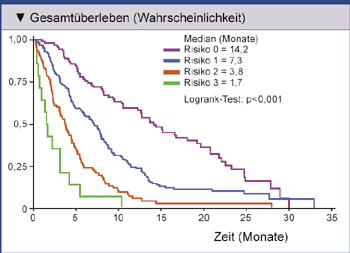
Abb. 2: Kaplan-Meier-Kurven für Gesamtüberleben bei Patienten mit Platin-refraktärem
Urothelkarzinom mit 0, 1, 2 oder 3 Risikofaktoren (Performance-Status >0, Hämoglobin-Wert <10 g/dl,
Lebermetastasen) [9].
Targeted Therapie mit Sunitinib bei Patienten mit metastasiertem Urothelkarzinom
In einer Phase-II-Studie wurden Effektivität und Wirksamkeit von Sunitinib (Tyrosinkinaserezeptor-Inhibitor)
bei 77 Patienten mit progressivem, metastasiertem, vorbehandeltem Karzinom der Harnblase, des Nierenbeckens,
des Ureters oder der Urethra geprüft.
Literatur:
[1] Stenzl A, Cowan NC, De Santis M, et al. 2009.
The updated EAU guidelines on muscle-invasive and metastatic bladder cancer. Eur Urol 55:815-825.
[2] Hautmann RE, de Petriconi RC, Volkmer BG, 2010.
Lessons learned from 1,000 neobladders: The 90-day complication rate. J Urol 184:990-994.
[3] Langsenlehner T, Döller C, Quehenberger F, et al. 2010.
Treatment results of radiation therapy for muscle-invasive bladder cancer. Strahlenther Onkol 186:203-209.
[4] von der Maase H, Sengelov L, Roberts JT, et al. 2005.
Long-term survival results of a randomized trial comparing gemcitabine plus cisplatin, with methotrexate, vinblastine,doxorubicine, plus cisplatin in patients with bladder cancer. J Clin Oncol 23:4602-4608.
[5] Ma Y, Yu WD, Trump DL, Johnson CS, 2010.
1,25D3 enhances antitumor activity of gemcitabine and cisplatin in human bladder cancer models. Cancer 116:3294-3303.
[6] da Silva GN, de Castro Marcondes JP, de Camargo EA, et al. 2010.
Cell cycle arrest and apoptosis in TP53 subtypes of bladder carcinoma cell lines treated with cisplatin and gemcitabine. Exp Biol Med (Maywood). 235:814-824.
[7] Bellmunt J, Theodore C, Demkov T, et al. 2009.
Phase III trial of vinflunine plus best supportive care compared with best supportive care alone after a platinum-containing regimen in patients with advanced transitional cell carcinoma of the urothelial tract. J Clin Oncol 27:4454-4461.
[8] Vaughn DJ, Srinivas S, Stadler WM, et al. 2009.
Vinflunine in platinum-pretreated patients with locally advanced or metastatic urothelial carcinoma: results of a large phase 2 study. Cancer 115:4110-4117.
[9] Bellmunt J, Choueiri TK, Fougeray R, et al. 2010.
Prognostic factors in patients with advanced transitional cell carcinoma of the urothelial tract experiencing treatment failure with platinum-containing regimens. J Clin Oncol 28:1850-1855.
[10] Gallagher DJ, Milowsky MI, Gerst SR, et al. 2010.
Phase II trial of sunitinib in patients with metastatic urothelial cancer. J Clin Oncol 28:1373-1379.
© 2003-2025 pro-anima medizin medien
–
impressum
–
mediadaten
–
konzeption
–
datenschutz
