

Prostatakrebs gehört zu den Krankheiten, bei denen davon auszugehen ist, dass sich eine Reduktion des Erkrankungsrisikos
besonders auszahlt: Die Prävalenz ist sehr hoch, die Latenzperiode erstreckt sich über Jahrzehnte und Morbidität wie auch
Mortalität sind signifikant. Verschiedene Ansätze der Chemoprävention mit Selen und/oder Vitamin E, selektiven
Estrogenrezeptor-
Homöostatisches Gleichgewicht zwischen Wachstum, Differenzierung und Apoptose
-
Wachstum und Funktion der Prostata sind auf vielfältige Weise von androgenen Stimuli abhängig. Denn von den in der
Prostata exprimierten Genen wurden über 200 als Androgen-reguliert identifiziert. Unter den Proteinprodukten dieser
Gene sind das Prostata-spezifische Antigen (PSA), Kallikrein 3, Kallikrein 2 und saure Phosphatase, sowie eine Reihe
von Proteinen, die bei der Regulierung des Zellzyklus und der Apoptose eine zentrale Rolle spielen.
In der gesunden Prostata besteht ein komplizierter Signalaustausch zwischen Stromazellen und Epithelzellen, der
das homöostatische Gleichgewicht zwischen Wachstum, Differenzierung und Apoptose aufrechterhält. Androgene stimulieren
in beiden Zellkompartimenten die Expression von Wachstums- und Überlebensfaktoren, über die die Zellen des jeweils
anderen Kompartiments beeinflusst werden. Der parakrine Mechanismus sorgt für Wachstum im Sinne ständiger Regeneration,
ohne dass sich die Gewebemenge insgesamt erhöht.
-
Nach dem so genannten Dreistufenmodell der Krebsentstehung (Initiation, Promotion und Progression) ist ein chronischer
oder rezidivierender Entzündungszustand in Verbindung mit Ernährungs- und genetischen Faktoren für Initiation und
Promotion verantwortlich. Vorstufen wie prostatische intraepitheliale Neoplasien (PIN) können sich dann zu latenten
gut differenzierten Tumoren entwickeln, die allmählich über Jahrzehnte zu invasiven, klinisch signifikanten
Prostatakarzinomen voranschreiten [3] (Abb. 1).
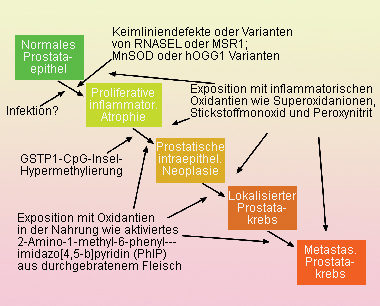
|
Abb. 1: Pathogenese von Prostatakrebs: Genetische (RNASEL, MSR1, MnSOD, hOGG1), epidemiologische (Infektion, inflammatorische
Oxidantien, Oxidantien in der Nahrung, Elektrophile) Beiträge und somatische Veränderungen des Genoms (GSTP1-CpG-Insel-Hypermethylierung)
driving neoplastische Transformation und maligne Progression via proliferative inflammatorische Atrophie und prostatische
intraepitheliale Neoplasie (PIN) zum lokalisierten sowie weiter zum metastasierten Prostatakrebs (Nelson et al. [3]). RNASEL gilt als Kanidaten-Suszeptibilitätsgen für Prostatakrebs. Es kodiert für eine latente Komponente einer Endoribonuklease in einem durch Interferon induzierbaren RNA-Abbauweg, die bei viraler Infektion aktiviert wird. GSTP1 kodiert für die Glutathion-S-Transferase (GST; -Klasse). GST katalysieren die Konjugation von Glutathion an verschiedene reaktive Verbindungen wie Oxidantien und schützen auf diese Weise vor der Entwicklung von Krebs. Die somatische Inaktivierung von GSTP1 weist auf die Rolle der Prostataentzündung bei der Entstehung von Prostatakrebs hin und unterstützt die These, dass proliferative inflammatorische Atrophie eine Vorstufe von Prostatakrebs ist. MSR1 kodiert für Untereinheiten eines homotrimeren Makrophagen-Scavanger (Straßenkehrer)-Rezeptors, der bakterielle Lipopoylsaccharide, Lipoteichonsäure sowie oxidierte Lipoproteine binden kann, und als Kanidaten-Suszeptibilitätsgen für Prostatakrebs gilt. MnSOD ( Mangan-Superoxid-Dismutase-Gen) kodiert für ein mitochondriales Enzym, dass Zellen vor oxidativen Schäden schützt und mit einem erhöhten Prostatakrebsrisiko in Verbindung gebracht wird. hOGG1 kodiert für ein Enzym, dass oxidative Schäden im Genom repariert. Varianten des Gens sind mit einem erhöhten Prostatakrebsrisiko assoziiert. |
Sowohl nach dem Dreistufenmodell als auch gemäß dem gegenwärtig bevorzugten Modell der mehrstufigen Karzinogenese ist eine Mutation in einem Gen, das an der Regulierung des Zellzyklus mitwirkt das primäre Ereignis. Die Frage, ob Androgene und/oder das Androgen/Estrogen-Verhältnis bei der unmittelbaren Auslösung von Prostatakrebs eine Rolle spielen, lässt sich nach heutigem Kenntnisstand nicht abschließend beantworten. Doch wenn überhaupt käme allenfalls den intraprostatischen Androgenspiegeln, die von der Menge der zirkulierenden Androgene in weiten Grenzen relativ unabhängig sind, eine Rolle zu. Das initiale Ereignis der Karzinogenese kann Männer (verschiedentlich werden schon Einflüsse in utero diskutiert) mit hohen oder niedrigen Testosteronspiegel gleichermaßen betreffen. Jedenfalls ergeben Analysen aller verfügbaren prospektiven epidemiologischen Daten kein Indiz für einen Zusammenhang zwischen Serum-Testosteronspiegel und Prostatakrebsrisiko [4].
Die vermutlich eigentliche Rolle der Androgene in der Karzinogenese von Prostatakrebs liegt in der Verschaffung eines Wachstumsvorteils für mutierte Zellen. Wahrscheinlich spielen hierbei die so genannten transit amplifying (TA)-Zellen eine zentrale Rolle. In der gesunden Prostata exprimieren die TA-Zellen, zu denen mit Ausnahme der Stammzellen alle proliferierenden Zellen der Basalschicht gehören, keine oder nur in geringem Maße Androgenrezeptoren. In den proliferierenden Zellen des Prostataepithels wurde bei Vorliegen einer proliferativen inflammatorischen Atrophie und vermehrt in hochgradigen PIN hingegen eine erhöhte Expression des Androgenrezeptors nachgewiesen. In solchen transformierten TA-Zellen wird die Proliferation durch aktivierte Androgenrezeptoren gefördert. Während Androgenrezeptoren in der gesunden Prostata eine Schlüsselrolle für die homöostatische Regulierung von Regeneration und Überleben innehaben, induzieren sie bei Prostatakrebs unkontrolliertes Wachstum, wobei die Umstellung von parakrinen auf autokrine Signalwege eine Rolle spielt [5].
Rekurrente Genfusionen eines Androgen-regulierten 5´-Gens mit einem Gen aus der ETS-Familie (Gruppe onkogen wirkender Transkriptionsfaktoren) sind ein weiteres Beispiel für die Bedeutung von Androgenen bei der Entstehung von Prostatakrebs (siehe andrologen.info Dezember 2008).
In Prostatakarzinomen induziert der aktivierte Androgenrezeptor unkontrolliertes Wachstum. Dem wird nach dem so
genannten Sättigungskonzept erst bei Erreichen eines Serum-Testosteronspiegels von Kastrationsniveau Einhalt geboten.
Bei höheren Serum-Testosteronspiegeln bis in den oberen physiologischen Bereich wird davon ausgegangen, dass stets
maximale Wachstumsstimulierung erfolgt.
-
Durch die Aktivität von 5alpha-Reduktase wird die androgene Stimulation der Prostata erheblich gesteigert. Das Enzym
katalysiert die Reduktion von Testosteron zu Dihydrotestosteron (DHT), dem in der Prostata hauptsächlich wirksamen,
potenteren Androgen als Testosteron.
Von 5alpha-Reduktase existieren zwei Isoenzyme, Typ 1 und Typ 2. Über ihr Vorkommen und ihre Verteilung in der Prostata gibt es zum Teil widersprüchliche Befunde. Während 5alpha-Reduktase Typ 1 in der gesunden Prostata übereinstimmend sowohl in Stroma- als auch in Epithelzellen lokalisiert wurde, sind die Befunde über das Vorkommen von 5alpha-Reduktase Typ 2 in Epithelzellen widersprüchlich.
Aus immunhistochemisch behandelten Gewebeschnitten von hyperplastischen Prostatae ließ sich auf eine niedrige Expression
von 5alpha-Reduktase Typ 1 und eine sehr hohe Expression von 5alpha-Reduktase Typ 2 schließen. Ferner wurde in
verschiedenen Stadien von Prostatakrebs eine deutliche Zunahme beider Isoenzyme von PIN über primäre und rezidivierende
Prostatakarzinome bis hin zu Metastasen registriert [6] (Abb. 2).
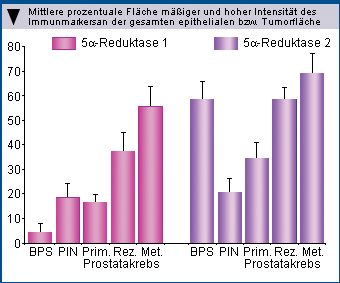
|
Abb. 2: Immunohistochemische Färbung von 5alpha-Reduktase Typ 1 und 2 in hyperplastischem Prostatagewebe und in prostatischen intraepithelialen Neoplasien (PIN), primären wie auch rezidivierenden Prostatakarzinomen sowie Metastasen (Thomas et al. 2005 [6]). |
-
Von den beiden 5alpha-Reduktaseinhibitoren Finasterid und Dutasterid hemmt ersterer den Typ 2 und letzterer beide Isoenzyme.
Durch die duale 5alpha-Reduktaseinhibition wird eine weitergehende und gleichbleibendere DHT-Suppression als nur mit der
Inhibition des Typ 1 erreicht.
Bei Männern, die mit einem 5alpha-Reduktaseinhibitor behandelt werden, sinkt der intraprostatische Spiegel an DHT zwar stärker
als nach Kastration, doch es erhöht sich im Gegenzug die intraprostatische Konzentration an Testosteron. Der Nettoeffekt auf
die prostatische Funktion ist bei der Kastration höher als bei der Behandlung mit einem 5alpha-Reduktaseinhibitor. Eine Steigerung
der Effektivität lässt sich durch die Kombination beider Methoden erreichen.
-
In der siebenjährigen, randomisierten, doppelblinden, Placebo-kontrollierten Prostate Cancer Prevention Trial (PCPT) wurde eine
gegen-über Placebo ca. 25 %ige Reduktion des Prostatakrebsrisikos bei prophylaktischer Einnahme von Finasterid ermittelt. Die
Teilnehmer waren Männer mit niedrig eingeschätztem Risiko für Prostatakrebs, deren PSA-Konzentration, und bei der Rekrutierung
3,0 ng/ml betrug, und bei denen die digitale rektale Untersuchung keine Auffälligkeiten ergab. Wir erinnern uns, dass die eigentlich
auf neun Jahre konzipierte Studie 15 Monate früher beendet wurde, weil die Beweise für das Erreichen einer reduzierten Prävalenz
von Prostatakrebs überwältigend waren. Die Veröffentlichung erfolgte im Jahr 2003 [7].
Der Wermutstropfen in der Auswertung der PCPT-Daten war aber eine prozentual höhere Anzahl schlecht differenzierter Karzinome mit
dem Gleason-Grad 7-10 bei den Fällen in der Finasterid-Gruppe. Als Erklärung hierfür wurde in erster Linie die verbesserte Entdeckung
von Prostatakarzinomen und insbesondere von schlecht differenzierten Foci angeführt (detection bias). Eine nochmalige ausführliche
Bewertung der PCPT-Daten findet sich in einem aktuell publizierten Übersichtsartikel von Thompson et al. zur Chemoprävention von Prostatakrebs [8].
-
In der vierjährigen, randomisierten, doppelblinden, Placebo-kontrollierten Reduction by Dutasteride of Prostate Cancer Events (REDUCE)
Study wurde unter Phase-III-Kriterien geprüft, inwieweit der duale 5-Reduktaseinhibitor Dutasterid die Inzidenz von Prostatakrebs in einem
Kollektiv von Männern mit hohem Prostatakrebsrisiko zu senken vermag. Daher wurden 50- bis 75-jährige Teilnehmer rekrutiert, deren PSA-Spiegel
bei den bis 60-Jährigen zwischen 2,5 und 10,0 ng/ml und bei den über 60-Jährigen zwischen 3,0 und 10,0 ng/ml lag (mittlerer PSA-Wert: 5,9 ng/ml).
Ferner war eine negative Biopsie während der sechs Monate vor Aufnahme in die Studie gefordert. Primärer Endpunkt in REDUCE war die Anzahl der
durch Biopsie entdeckten Prostatakarzinome. Zu den sekundären Endpunkten zählte insbesondere der Gleason Score bei den diagnostizierten Tumoren.
Dutasterid verringerte das Prostatakrebsrisiko innerhalb von vier Jahren gegenüber Placebo um 23 %. Insgesamt wurde bei 1 516 Patienten (22,5 %) ein Prostatakarzinom diagnostiziert. Von diesen Patienten hatten 857 ein Placebo erhalten und 659 waren mit Dutasterid behandelt worden. Alle Prostatakarzinome hatten einen Gleason Score 5. Die Mehrheit der Prostatakarzinome wurde in den ersten beiden Jahren der Studie entdeckt. Allerdings betrug die Risikoreduktion weiterhin 23,5 % als die zweite Runde der Biopsien im vierten Jahr durchgeführt wurde. Ferner zeigten Subgruppenanalysen, dass die Risikoreduktion bei allen Risikogruppen einheitlich war.
Als erfreulicher Aspekt der Ergebnisse von REDUCE ist festzuhalten, dass keine Erhöhung der schlecht differenzierten Karzinome registriert wurde. Der Anteil an Karzinomen vom Gleason Score 7-10 betrug in der Placebogruppe 6,8 % und in der Dutasterid-Gruppe 6,7 %. Bei den Tumoren vom Gleason Grad 8-10 wurde ein Verhältnis von 0,6 % zu 0,9 % registriert.
An Nebenwirkungen traten am häufigsten eine geringgradige Verringerung der Libido und erektile Dysfunktion auf. Nur 4,3 % der Teilnahme beendeten
die Einnahme von Dutasterid vorzeitig [9].
-
Die Konzipierung der Selenium and Vitamin E Cancer Prevention Trial (SELECT) basierte auf epidemiologische, molekularbiologische
und klinische Indizien für eine Reduktion des Prostatakrebsrisikos durch die Antioxidantien.
Als Hazard Ratios wurden nach fünfeinhalbjähriger Nachbeobachtung für Selen 1,04, für Vitamin E 1,13 und für die Kombination von Selen und Vitamin E 1,05 ermittelt [10]. Anstatt einer Reduktion des Prostatakrebsrisikos wurde für Vitamin E eine nicht signifikante Risikoerhöhung errechnet. Bei der Interpretation des Ergebnisses für Selen sollte berücksichtigt werden, dass die Ausgangsspiegel des Selens bei den Teilnehmern mit 135 ng/ml bereits relativ hoch lagen. In Deutschland werden meist deutlich niedrigere Werte gemessen.
Als Ergänzung zu SELECT lief eine molekularbiologisch geprägte, randomisierte, Placebo-kontrollierte Phase-IIA-
-
In einem kürzlich publizierten Cochrane Review wurde die Schlussfolgerung gezogen, 5-alphaReduktaseinhibitoren hätten das Potenzial,
vor Prostatakrebs zu schützen [12].
In der aktuellen S3-Leitlinie Prostatakarzinom findet sich folgendes Statement:
Die Einnahme von 5alpha-Reduktasehemmern reduziert die Häufigkeit des Nachweises von Prostatakarzinomen und Präneoplasien (PIN).
Allerdings existieren keine Hinweise zur Auswirkung auf tumorspezifische Mortalität oder Gesamtmortalität.
Der PSA-Wert wird durch 5alpha-Reduktasehemmer abgesenkt.
In Deutschland sind 5alpha-Reduktasehemmer in der Prävention des Prostatakarzinoms nicht zugelassen.
Literatur:
[1] Andriole GL, 2009. Overview of pivotal studies for prostate cancer risk reduction, past and present. Urology 73 (Suppl 5A):36-43.
[2] Fitzpatrick JM, Schulman C, Zlotta AR, Schröder FH, 2009. Prostate cancer: a serious disease suitable for prevention. BJU Int 103:864-870.
[3] Nelson WG, De Marzo AM, De Weese TL, Isaacs WB, 2004. The role of inflammation in the pathogenesis of prostate cancer. J Urol 172:S6-S12.
[4] Endogenous Hormones and Prostate Cancer Collaborative Group, 2008. Endogenous sex hormones and prostate cancer: a collaborative analysis of 18 prospective studies. J Natl Cancer Inst 100:170-183.
[5] Tindall DJ, Rittmaster RS, 2008. The rationale for inhibiting 5alpha-reductase isoenzymes in the prevention and treatment of prostate cancer. J Urol 179:1235-1242.
[6] Thomas LN, Lazier CB, Gupta R, et al. 2005. Differential alterations in 5alpha-reductase type 1 and type 2 levels during development and progression of prostate cancer. Prostate 63:231-239.
[7] Thompson IM, Goodman PJ, Tangen CM, et al. 2003. The influence of finasterid on the development of prostate cancer. N Engl J Med 349:215-224.
[8] Thompson IM, Tangen CM, Goodman PJ, et al. 2009. Chemoprevention of prostate cancer. J Urol 182:499-508.
[9] Andriole GL, 2009. Headline results of the REDUCE trial: the effect of dutasteride on prostate cancer risk reduction. Chicago: 107th Annual Meeting, American Urological Association; 2009.
[10] Lippman SM, Klein EA, Goodman PJ, et al. 2009. Effect of selenium and vitamin E on risk of prostate cancer and other cancers: the Selenium and Vitamin E Cancer Prevention Trial (SELECT). JAMA 301:39-51.
[11] Tsavachidou D, McDonnell TJ, Wen S, et al. 2009. Selenium and vitamin E: cell- and intervention-specific tissue effects in prostate cancer. J Natl Cancer Inst 101:306-320.
[12] Wilt TJ, MacDonald R, Hagerty K, et al. 2008. Five-alpha-reductase inhibitors for prostate cancer prevention. Cochrane Database Syst Rev 2:CD007091.
© 2003-2025 pro-anima medizin medien
–
impressum
–
mediadaten
–
konzeption
–
datenschutz
