

PSA-Screening, Überdiagnose, Active Surveillance: Update 2012
Active Surveillance wird zunehmend als geeignete, zukunftsträchtige Behandlungsstrategie bei low-
-
Bei verbreiteter Inanspruchnahme eines PSA-Screenings wächst der Kreis der Männer, der sich mit einer
Prostatakrebs-
-
Während der Ära, als Krebs bei Patienten im Wesentlichen erst diagnostiziert wurde, wenn sie Symptome der Krankheit
Seit der breiten Einführung sensitiver Tests zur Diagnose von Prostatakrebs stellt sich das Problem der Überdiagnose.
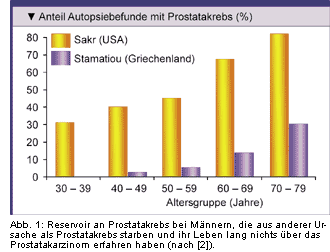
-
Mit dem PSA-Screening auf Prostatakrebs sind im Vergleich zur klinischen Diagnose potenziell letale Prostatakarzinome zu
einem deutlich früheren, eher kurablem Stadium auffindbar. Parallel zur Ausbreitung des PSA-Screenings in den westlichen
Industriestaaten kam es zu einem deutlichen Absinken der Prostatakrebs-
Von verschiedenen Studien zum PSA-Screening stehen sich die Prostate, Lung, Colorectal, and Ovarian (PLCO) Screening
Study (76.693 Männer randomisiert) und die European Randomized Study of Screening for Prostate Cancer (ERSPC; 162.388
Teilnehmer mit diskrepanten Ergebnissen gegenüber. Während PLCO keinen Benefit für das Screening erbrachte, wies die
größere ERSPC eine um 20% reduzierte Prostatakrebs-
Ein vorläufiges klinisches Gutachten (PCO; Provisional Clinical Opinion) der American Society of Clinical Oncology (ASCO)
spiegelt den Konsens von Experten auf der Grundlage der aktuellen klinischen Beweislage zu einem bestimmten Thema wider.
Ein von der Agency for Healthcare Research and Quality (AHRQ) 2011 erstellter Review diente als hauptsächliche
Informationsquelle der aktuellen PCO für Indizien zu Nutzen und Risiken des PSA-
Die Rationale für das Screening von Männern auf Prostatakrebs ist die Möglichkeit, damit durch frühzeitige Entdeckung des
Krebses das Risiko für Prostatakrebs-
Bei Männern mit einer Lebenserwartung von mehr als 10 Jahren sollten Ärzte mit ihren Patienten besprechen, ob das Testen
des PSA-
-
Im Jahr 2010 empfahl das amerikanische National Comprehensive Cancer Network (NCCN) die Anwendung von Active Surveillance nicht
nur als Option, sondern als einzige initiale Behandlungsstrategie für Patienten mit einem low-
Patienten mit einem einzigen Prostatakrebs-Mikrofokus sind ideale Kandidaten für Active Surveillance. In diesem Zusammenhang erwies sich die Anzahl der Stanzen als wesentlicher Prädiktor für insignifikanten Prostatakrebs, der bei der initialen Prostatabiopsie als singulärer Mikrofokus diagnostiziert worden war [7]. Daten von 233 Patienten bei deren initialer Prostatabiopsie ein einzelner Mikrofokus entdeckt worden war (Gleason Score: 6 und 5% der Stanze umfassend), und die sich anschließend einer radikalen Prostatektomie unterzogen hatten, wurden dahingehend analysiert, inwieweit die Anzahl der entnommenen Stanzen und die Wahrscheinlichkeit der Bestätigung von indolentem Krebs zu vereinbaren sind: Bei 65 der 233 Patienten (28 %) wurde das Prostatakarzinom nach radikaler Prostatektomie als pathologisch insignifikant eingestuft. Die Rate der Übereinstimmung mit der Prostatabiopsie betrug 3,8%, 29,6% und 39,4% bei Patienten mit 12 Stanzen, 13–18 Stanzen bzw. 19 Stanzen.
Eine Arbeitsgruppe aus dem Memorial Sloan Kettering Cancer Center in New York untersuchte, inwieweit endorektale
Magnetresonanz-
-
Protokolle für Active Surveillance bei low-risk Prostatakrebs sehen generell wiederholte Biopsien in im Voraus festgelegten Intervallen
vor. Selbst bei Anwendung sehr stringenter Kriterien kommt es bei einem nicht unerheblichen Prozentsatz der Patienten, die für Active
Surveillance geeignet erscheinen, zur Fehlklassifizierung (die Angaben reichen von 16% bis 42%). Bei der Durchsicht jüngerer
Veröffentlichungen zur erneuten Ermittlung des Gleason-Grads nach Prostatektomie oder Rebiopsie bei Prostatakrebs-Patienten, die
für Active Surveillance als geeignet eingestuft worden waren (Gleason Score ≤6), ergab die Bewertung der initialen Biopsie bei mehr
als einem Drittel der Männer einen zu niedrigen Gleason-
Die erste Wiederholungsbiopsie nach einem Follow-up von einem Jahr bei 757 Patienten eines prospektiven Active-
Aus der PRIAS-Studie wurde der pathologische Befund nach radikaler Prostatektomie von Patienten berichtet, die ursprünglich mit low-
-
Protokolle für Active Surveillance beinhalten neben der engmaschigen Überwachung der PSA-
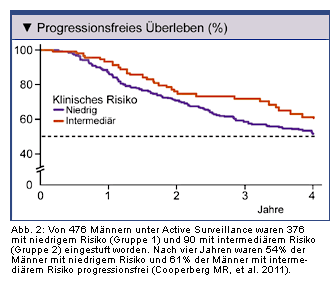
Patienten mit Intermediärrisiko-Prostatakrebs, d.h. mit einem Gleason Score 3 + 4 oder einem PSA-Spiegel über 10 ng/ml bilden mit 29% auch
einen beträchtlichen Bestandteil der Studienkohorte an der Universität Toronto. Die Patienten sind über 70 Jahre alt und mit signifikanter
Komorbidität belastet. Dennoch wird eine niedrige 10-jährige krebsspezifische Mortalität berichtet [9].
-
In der Shared Equal Access Regional Cancer Hospital (SEARCH)-Datenbank wurden 1.561 Männer mit low-
Auch ausgewählte Prostatakrebs-Patienten mit intermediärem Risikoprofil werden als mögliche Kandidaten für Active Surveillance
erachtet [14]. Prostatakrebs-
-
Gegenwärtig gibt es noch kaum gesicherte Erkenntnisse zu klinisch relevanten Krankrankheitsergebnissen nach Active Surveillance.
Das wird sich wahrscheinlich erst mit dem Voranschreiten aktuell laufender Programme zu Active Surveillance ändern.
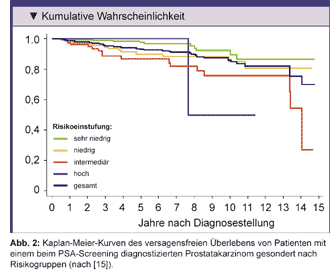
-
Durch Untergliederung des Zeitintervalls von der Diagnose bis zur Prostatakrebs-Mortalität in verschiedene Phasen wurde ein
Simulationsmodell entwickelt, das die Prostatakrebsmortalität unter Active Surveillance gefolgt von radikaler Prostatektomie
gegenüber unmittelbarer radikaler Prostatektomie abbildet. Für Männer unter Active Surveillance umfasst das Modell die Zeit
von der Diagnose bis zur radikalen Prostatektomie infolge des Verdachts auf Progression (I), darüber hinaus die Zeit bis zum
Rezidiv (II) und die anschließende Zeit bis zu Prostatakrebs-
-
Weltweit laufen eine Reihe prospektiver Beobachtungsstudien zu Active Surveillance, deren abschließende Beurteilungen mehrheitlich
erst in einigen Jahren vorliegen dürften. Im deutschsprachigen Raum wurde eine große urologische Versorgungsstudie zur Ermittlung
der Lebensqualität bei der Therapie des lokal begrenzten Prostatakarzinoms initiiert:
Hormontherapie – Aktive Überwachung – Radiotherapie – Operation – Watchful Waiting (HAROW) wurde von der gemeinnützigen Stiftung Männergesundheit mit finanzieller Unterstützung durch die GAZPROM Germania GmbH ins Leben gerufen. Die Studie ist ferner eine Zusammenarbeit des Berufsverbands der Deutschen Urologen e.V. (BDU), des Dachverbands der Prostatazentren Deutschlands e.V. (DVPZ) und des Bundesverbands Prostatakrebs Selbsthilfe e.V. (BPS). Mit der Versorgungsstudie wird die Validierung der Entscheidung von Patienten mit lokalisiertem Prostatakrebs für Active Surveillance angestrebt.
Hierzu ist vorgesehen, die Angaben von 5.000 Patienten mit lokal begrenztem Prostatakarzinom zu Tumor-charakteristika, Krankheitsverlauf, Arzt-Patient-Beziehung und Gesundheitsökonomie auszuwerten. Das Ziel ist die Entwicklung von Kriterien, die verlässlich anzeigen, ob eine definitive Behandlung eingeleitet werden muss oder zurückgestellt werden kann. Bei der Zwischenauswertung im Jahr 2011 lagen für 1.873 Patienten Angaben zur Therapieentscheidung vor: Bei 1 009 (53%) war eine radikale Prostatektomie vorgesehen und 355 (19%) sollten defensiv betreut werden (Active Surveillance 265/Watchful Waiting 91). Für eine Bestrahlung entschieden sich 227 Patienten (12%). Im Vergleich zur Vorjahresauswertung ergab sich eine leichte Zunahme der Anwendung abwartender Strategien (+5%) zu Lasten der radikalen Prostatektomie (-3%; Abb. 3).
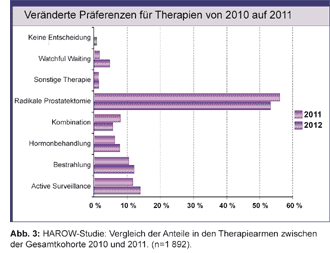
Die Einschlusskriterien der PRIAS-Studie sind etwas weiter gefasst als in der Leitlinie. Die HAROW-Studie hält es aufgrund
der hohen wissenschaftlichen Akzeptanz der PRIAS-Studie für vertretbar, Active Surveillance auch Patienten anzubieten, die den
PRIAS-
Bei den Folgeuntersuchungen ist die vierteljährliche Bestimmung des PSA-Werts vorgesehen. Eine Rebiopsie ist erst nach zwölf
Monaten und dann nach vier, sieben und zehn Jahren erforderlich.
Literatur:
[1] Bangma CH, Bul M, van der Kwast, et al. 2012.
Active surveillance for low-risk prostate cancer. Crit Rev Oncol Hematol August 6 [Epub ahead of print].
[2] Klotz L, 2012. Active surveillance for low-risk prostate cancer.
F1000 Medicine Reports 4:16 (doi:10.3410/M4-16)
[3] Welch HG, Black WC, 2010. Overdiagnosis in cancer. J Natl Cancer Inst 102:605-613.
[4] Wever EM, Draisma G, Heijnsdijk EAM, de Koning HJ, 2011.
How does early detection by screening affect disease progression? Modeling estimated benefits in prostate cancer screening.
Med Decis Making 31:550-558.
[5] Schröder FH, 2012.
Landmarks in prostate cancer screening. BJU Int 110(Suppl.):3-7.
[6] Basch E, Oliver TK, VickersA, et al. 2012.
Screening for prostate cancer with prostate-specific antigen testing: American Society of Clinical Oncology Provisional Clinical Opinion.
J Clin Oncol, July 16, [Epub ahead of print].
[7] Villa L, Capitanio U, Briganti A, et al. 2012.
The number of cores taken is a major predictor of insignificant prostate cancer in patients diagnosed with a single microfocus at initial biopsy:
Implications for the selection of candidates suitable for active surveillance. J Urol pii:S0022-5347(12)04996-8
[8] Vargas HA, Akin O, Afaq A, et al. 2012.
Magnetic resonance imaging for predicting prostate biopsy findings in patients considered for active surveillance
of clinically low risk prostate cancer. J Urol 188:1732-1738.
[9] Shapiro RH, Johnstone PAS, 2012.
Risk of Gleason grade inaccuracies in prostate cancer patients eligible for active surveillance. Urology 80:661-666.
[10] Bul M, van den Bergh RC, Rannikko A, et al. 2012.
Predictors of unfavourable repeat biopsy results in men participating in a prospective active surveillance program. Eur Urol 61:370-377.
[11] Bul M, Zhu X, Rannikko A, et al. 2012.
Radical prostatectomy for low-risk prostate cancer following initial active surveillance: results from a prospective observational study.
Eur Urol 62:195-200.
[12] Han JS, Toll AD, Amin A, et al. 2012.
Low prostate-specific antigen and no Gleason score upgrade despite more extensive cancer during active surveillance predicts
insignificant prostate cancer at radical prostatectomy. Urology 80:883-888.
[13] Abern MR, Aronson WJ, Terris MK, et al. 2012.
Delayed radical prostatectomy for intermediate-risk prostate cancer is associated with biochemical recurrence: possible implications
for active surveillance from the SEARCH database. Prostate DOI: 10.1002/pros.22582
[14] Cooperberg MR, Cowan JE, Hilton JF, et al. 2011.
Outcomes of active surveillance for men with intermediate-risk prostate cancer. J Clin Oncol 29:228-234.
[15] Godtman RA, Holmberg E, Khatami A, et al. 2012.
Outcomes following active surveillance of men with screen-detected prostate cancer. Results from the Göteborg Randomized
Population-based Prostate Cancer Screening Trial. Eur Urol September 5. [Epub ahead of print].
[16] Xia J, Trock BJ, Cooperberg MR, et al. 2012.
Prostate cancer mortality following active surveillance versus immediate prostatectomy. Clin Cancer Res 18:5471-5478.
© 2003-2025 pro-anima medizin medien
–
impressum
–
mediadaten
–
konzeption
–
datenschutz
