

Inwieweit ist PSA ein Marker für Effekte von Testosteron an der Prostata?
Physiologische Testosteroneffekte an der Prostata wie die Regulierung Androgen-abhängiger Gene führen bei gesunder, intakter Drüse zu keiner Abgabe von
Prostata-
-
Prostata-spezifisches Antigen (PSA) ist ein Glykoprotein und gehört zur „15-köpfigen“ Familie der Gewebskallikreine,
deren Gene allesamt auf dem langen Arm von Chromosom 19 (19q133-4) in einem ca. 280 Kilobasen umfassenden Lokus positioniert
sind. In der rationalen Benennung erhält PSA den Namen humanes Kallikrein 3 (hK3) und sein kodierendes Gen die Bezeichnung KLK3.
-
... das physiologischerweise in die Samenflüssigkeit abgegeben wird, umfassen die Verflüssigung des nach der Ejakulation im
Seminalplasma entstehenden Koagulums und möglicherweise auch die Beteiligung an der Auflösung des Zervikalschleims. Die Hauptmenge
des PSA in der Samenflüssigkeit ist eine aktive Serin-Protease mit Chymotrypsin-ähnlicher Aktivität.
-
... ist Androgen-abhängig. Sie wird über die Ausbildung eines so genannten Transkriptionsapparates unter Beteiligung von Androgen-
Erhöhte PSA-Spiegel im Blut bei Männern mit Prostatakrebs lassen sich nicht durch eine verstärkte Expression von PSA in den Tumorzellen erklären. Im Gegenteil
wurde gerade bei aggressiven Prostatakarzinomen sogar eine verminderte PSA-Produktion nachgewiesen [1]
-
... hängt das zunächst mit dem Verlust der strukturellen und funktionellen Integrität der epithelialen Auskleidung der tubulo-alveolären Drüsen und/oder
der Ausführungsgänge zusammen. Die Epithelien bilden eine hermetische Grenze zwischen Drüsenlumen und interstitiellem Gewebe, die durch verschließende
Zellhaften (tight junctions; Zonulae occludentes) im apikolateralen Bereich aneinandergrenzender Zellen aufrechterhalten wird (Abb.). Große Moleküle wie
PSA können die Barriere normalerweise nur an Stellen überwinden, wo die Verbindung vorübergehend gelöst wird. Das geschieht im Rahmen der ständigen Regeneration
des Epithels. Auf diesem Weg gelangen physiologischerweise aber nur verschwindend geringe Mengen an PSA ins Gewebe und von da aus ins Blut.
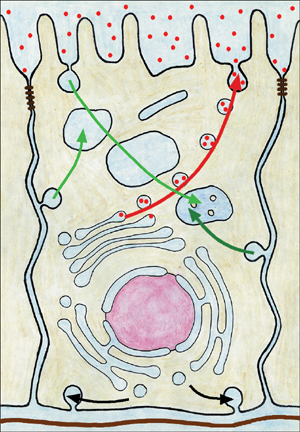
|
Idealisierte Prostataepithelzelle, die über tight junctions im Bereich der apikolateralen Zelloberfläche mit benachbarten Zellen verbunden ist. Größere
Moleküle wie PSA (rot) gelangen bei intaktem Epithel nicht aus dem Prostatasekret in die intersitielle Flüssigkeit und von da ins Blut. Endo- und Exozytose
findet zwar an der gesamten Zelloberfläche statt, doch aufgrund der Polarität der Epithelzelle ist der vesikuläre Transport in der Zelle zielgerichtet,
d.h. Sekretionsprodukte werden nur zur apikalen Zelloberfläche transportiert und durch Verschmelzen der Vesikelmembran mit der Plasmamembran ausgeschleust.
Apikale und basolaterale Plasmamembran unterscheiden sich insbesondere in ihren Proteinbestandteilen. Bei nicht zielgerichtetem vesikulären Transport könnte
die Trennung nicht aufrechterhalten werden. N = Zellkern, E = Endosom, L = Lysosom, G = Golgi-Apparat, BM = Basalmembran |
Wesentlich für die Barrierefunktion des Epithels ist auch die Polarität der Epithelzellen, durch die endozytotische und exozytotische Aktivitäten an der apikalen von denen an der basolateralen Zelloberfläche funktionell strikt getrennt sind. Mittels Immunhistochemie lassen sich die apikale und die basolaterale Plasmamembran als unterschiedlich zusammengesetzte Zellkompartimente erkennen. Diese Polarität geht bei maligner Transformation allmählich verloren. Letztlich findet die Sekretion von PSA ohne Orientierung an der gesamten Zelloberfläche statt, wie das auch bei Metastasen anzunehmen ist.
-
... von PSA wurden insbesondere im Blut identifiziert. Die Hauptmenge hiervon bilden stabile Komplexe mit verschiedenen, im Blut in hoher Konzentration vorkommenden
Protease-
Komplementär zu cPSA tritt im Blut auch eine Fraktion an freiem PSA (fPSA) auf, die diagnostisch von Bedeutung sein kann, denn das Verhältnis von Gesamt- zu fPSA (das meist als Prozentsatz des fPSA am Gesamt-PSA (%fPSA) ausgedrückt wird, ist bei erhöhten PSA-Werten infolge benigner Prostatahyperplasie (BPH) in der Regel größer als bei erhöhten PSA-Werten infolge eines Prostatakarzinoms.
Das fPSA im Blut ist eine Mischung verschiedener PSA-Varianten (intakte, trunkierte, „nicked“ Formen), deren jeweilige Molekülstruktur die Komplexbindung mit den
Protease-
-
... implizierte, dass Testosteron in die Pathogenese von Prostataerkrankungen eingebunden ist. Doch bereits 1995 hatten Monath et al. bei 150 Männern ohne
vorausgegangene Prostatakrebserkrankung ermittelt, dass keine Korrelation zwischen Testosteron und PSA besteht. Dieses Ergebnis hatte auch nach Korrekturen
für Alter und Körpergewicht Bestand. Die Untersucher zogen daraus die Schlussfolgerung, dass durch die simultane Bestimmung der Serum-Testosteronkonzentration
weder die Sensitivität noch die Spezifität von PSA als Tumormarker verbessert werden könnten [2].
Diese Ergebnisse wurden jüngst bestätigt und insofern erweitert, als gezeigt wurde, dass die Höhe des Serum-
-
... doch andererseits entwickelt sich auch keine BPH ohne sie, wie Roehrborn (2008) in einem Übersichtsartikel zur Pathologie der BPH feststellt. Das bestätigt
sich bei Männern, die bereits vor der Pubertät kastriert wurden. Sie behalten ihr Leben lang eine kleine Prostata. Ferner führt auch Androgendeprivation bei
erwachsenen Männern zur Involution der Prostata. Demnach kommt dem Testosteron bzw. dem DHT allenfalls eine permissive Rolle bei der Entwicklung einer BPH zu [4].
Im Alter sinkt bei Männern der Testosteronspiegel im Blut. Allerdings hat das kaum Einfluss auf die intraprostatischen DHT-Spiegel. Im Einklang damit fanden
Marberger et al. (2006) bei einem Kollektiv von Patienten mit BPH keinen Zusammenhang zwischen Serum-Testosteronspiegel, Serum-PSA und Prostatavolumen [5] (Tabelle).
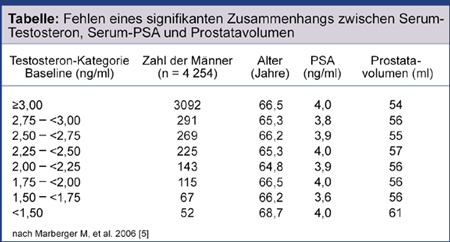
-
... wird seit der bahnbrechenden Arbeit von Huggins und Hodges im Jahr 1941 spekuliert, als die später Nobelpreis-gekrönte Entdeckung, dass das Wachstum von
Prostatakarzinomen durch Kastration gestoppt werden kann [6], den Anstoß für die heute standardmäßig angewandte Androgendeprivationstherapie (ADT) gegeben hat.
Daraus ergibt sich eine der wenigen gesicherten und allgemein anerkannten Aussagen zu Testosteron und Prostatakrebs: Prostatakrebs ist in den meisten Fällen ein
Androgen-
Andererseits wurde besagter Arbeit von Huggins und Hodges entnommen, dass die Gabe von Testosteron bei Männern mit Prostatakrebs das Tumorwachstum beschleunigt. Die Autoren hatten drei ihrer Patienten, die zuvor kastriert worden waren, um den Tumor zur Regression zu bringen, mit täglich 25 mg Testosteronpropionat i.V. behandelt. Sie registrierten daraufhin einen steilen Anstieg der sauren Phosphatase im Serum. In folgenden Untersuchungen mit Prostatakrebspatienten, die sich vor einer Testosterontherapie keinem Entzug der androgene unterzogen hatten, kam es zu keinem Anstieg der sauren Phosphatase und zu keinen klinischen Symptomen. Eine Erklärung hierfür liefert das so genannte Sättigungskonzept, wonach normale endogene Serum-Testosteronspiegel ausreichen, um eine praktisch maximale Wachstumsstimulierung von Prostatakarzinomen zu bewirken. Erst ein Absenken des Testosteronspiegels auf Kastrationsniveau hat signifikante Effekte auf das Wachstum von Prostatakrebs.
Interessante Ergebnisse zum Einfluss des Serum-Testosteronspiegels auf das Prostatakrebsrisiko lieferte eine multinationale Studie, in der 17 049 Männer im Mittel
8,7 Jahre nachverfolgt worden waren: Weder Testosteron noch adrenale Androgene standen im Zusammenhang mit einem erhöhten Risiko für nicht aggressiven (low grade)
Prostatakrebs. Andererseits halbierte sich das Risiko für aggressiven Prostatakrebs bei einer Verdopplung des Serum-Testosteronspiegels [7].
-
... der in den Prostataepithelzellen via Aromatisierung gebildet wird. Zudem kommt es bei Männern im Alter häufig zu einer relativen Estrogendominanz. Parallel
dazu vergrößert sich das Volumen der Prostata. Dass hierbei ein Zusammenhang bestehen könnte, ergibt sich aus Befunden, wonach die Männer mit der am stärksten
ausgeprägten BPH meist auch die höchsten Estradiol-Spiegel aufweisen.
Estrogene Wirkungen kommen entweder über den Erstrogenrezeptor (ER) oder der den ER zustande. Aus der Verteilung der beiden Rezeptoren in der Prostata lässt sich auf deren Rolle in der Pathogenese der BPH schließen.
Bei der Frage nach Zusammenhängen zwischen Testosteron und Prostatakarzinom – so es denn welche gibt – muss zum einen untersucht werden, ob Testosteron die Entstehung von Prostatakrebs begünstigt und/oder andererseits das Wachstum eines bestehenden Prostatakarzinoms beeinflusst. Das oft vorgebrachte Argument, Prostatakrebs hätten Männer erst im fortgeschrittenen Alter, wenn der Testosteronspiegel bereits abgefallen ist, trägt im Grunde nicht wirklich zur „Freisprechung“ des Hormons als Beteiligten im Rahmen der Karzinogenese bei. Dieser Rahmen muss mit bis zu 40 Jahren recht weit gesteckt werden, so dass der Zeitpunkt der Krebsentstehung in den Lebensabschnitt fällt, in dem der Testosteronspiegel normalerweise am höchsten ist.
Curruba (2007) stellt in einem Übersichtsartikel dar, dass Indizien sogar für die Entstehung präkanzeröser oder maligner Läsionen bereits in utero sprechen [8]. An Tiermodellen hatten Prins et al. (2007) gezeigt, dass eine anormal hohe Exposition mit Estrogenen während der kritischen Entwicklungsperiode in utero zu dauerhaften Veränderungen der Prostatamorphologie und -funktion führt – ein Prozess, der mit Estrogen-Imprinting bezeichnet wird [9].
Für den zunächst paradox erscheinenden Befund der Prostate Cancer Prevention Trial (PCPT), wonach sich die Prostatakrebsinzidenz unter dem 5alpha-Reduktase-Inhibitor
Finasterid zwar deutlich verringerte, aber zugleich der Anteil schlecht differenzierter (Gleason Score 7) Tumoren in der Behandlungsgruppe den in der Placebo-Gruppe
signifikant übertraf, wird neben einem Detection Bias unter anderem auch diskutiert, ob die Verschiebung des Androgen-/Estrogengleichgewichts in der Prostata hierfür
eine Rolle spielt [8].
-
... haben Urologen vielfach die Befürchtung, „schlafende Hunde zu wecken“. Einerseits haben Autopsie-Analysen bis zu. ca. 30 % der Männer latenten oder okkulten
Prostatakrebs. Die Prävalenz hat sich in der PSA-Ära allerdings deutlich verringert [10]. Andererseits ist die Ansicht nach wie vor weit verbreitet, Prostatakarzinome
wüchsen bei exogener Zufuhr von Testosteron.
Eine aktuelle Analyse zum Prostatakrebsrisiko hypogonadaler Männer unter einer Testosteronsubstitutionstherapie unternahmen Shabsigh et al. (2009). In ihrer systematischen
Literaturübersicht identifizierten sie 44 Untersuchungen, in denen Männer mit niedrigem oder im unteren Normbereich liegendem Testosteronspiegel und den Symptomen eines
Hypogonadismus mit Testosteron behandelt worden waren. Ferner waren Fälle von Prostatakrebs in diesen Studien histologisch bestätigt worden. Es handelte sich um elf
randomisierte, Placebo-kontrollierte Studien, 29 nicht kontrollierte Untersuchungen mit Männern ohne vorausgegangene Prostatakrebserkrankung und vier Studien, in denen
hypogonadale Männer nach überstandenem Prostatakrebs mit Testosteron behandelt worden waren. In keiner der 44 Studien wurde nachgewiesen, dass Testosteron in der Therapie
hypogonadaler Männer zu einer Zunahme des Prostatakrebsrisikos führt. Es wurden auch keine Unterschiede im Gleason Score bei den entdeckten Prostatakarzinomen zwischen
Fällen mit und ohne Testosteronbehandlung festgestellt [11].
Literatur:
[1] Magklara A, Scorilas A, Stephan C, et al. 2000.
Decreased concentration of prostate-specific androgen and human glandular kallikrein 2 in malignant vs. nonmalignant prostatic tissue. Urology 56:527-532.
[2] Monath JR, McCullough DL, Hart LJ, Jarow JP, 1995.
Physiologic variations of serum testosterone within the normal range do not affect serum prostate-specific antigen. Urology 46:58-61.
[3] Grober ED, Lamb DJ, Khera M, et al. 2008.
Correlation between simultaneous PSA and serum testosterone concentrations among eugonadal, untreated hypogonadal and hypogonadal men receiving testosterone replacement therapy. Int J Impot Res 20:561-565.
[4] Roehrborn CG, 2008.
Pathology of benign prostatic hyperplasia. Int J Impot Res 20:S11-S18.
[5] Marberger M, Roehrborn CG, Marks LS, et al. 2006.
Relationship among serum testosterone, sexual function, and response to treatment in men receiving dutasteride for benign prostatic hyperplasia. J Clin Endocrinol Metab 91:1323-1328.
[6] Huggins C, Hodges CV, 1941.
Studies on prostatic cancer, I: the effect of castration, of estrogen and of androgen injection on serumphosphatases in metastatic carcinoma of the prostate. Cancer Res 1:293-297.
[7] Severi G, Morris HA, MacInnis RJ, et al. 2006.
Circulating steroid hormones and the risk of prostate cancer. Cancer Epidemiol Biomarkers Prev 15:86-91.
[8] Carruba G, 2007.
Estrogen and prostate cancer: an eclipsed truth in an androgen-dominated scenario. J Cell Biochem 102:899-911.
[9] Prins GS, Birch L, Wan-Yee Tang W-Y, Ho SM, 2007.
Developmental estrogen exposures predispose to prostate carcinogenesis with aging. Reprod Toxicol 23:374-382.
[10] Konety BR, Bird VY, Deorah S, Dahmoush L, 2005.
Comparison of the incidence of latent prostate cancer detected at autopsy before and after the prostate specific era. J Urol 174:1785-1788.
[11] Shabsigh R, Crawford ED, Nehra A, Slawin KM, 2009.
Testosterone therapy in hypogonadal men and potential prostate cancer risk: a systematic review. Int J impot Res 21:9-23.
© 2003-2025 pro-anima medizin medien
–
impressum
–
mediadaten
–
konzeption
–
datenschutz
