
Die hormonale Therapie birgt erhebliche metabolische Risiken
Die Androgendeprivationstherapien (ADT) hat in der Behandlung des lokal fortgeschrittenen und des
metastasierten Prostatakarzinoms einen festen Platz. Sie bewirkt eine Supprimierung des Spiegels an
Prostata-
-
Nebenwirkungen einer ADT wie Gynäkomastie, Sexualstörungen, Osteoporose, unvorteilhaft veränderte
Körperzusammensetzung und eine verringerte Lebensqualität sind häufig beschrieben worden. Nachdem
auch metabolische Komplikationen des Androgenentzugs stärker in den Blickpunkt rücken, gilt es Nutzen
und Risiken einer ADT individuell sorgsam abzuwägen.
In den beiden letzten Jahrzehnten ist der Kreis der Prostatakrebs-Patienten, bei denen eine ADT als
sinnvoll erachtet wird, erheblich ausgeweitet worden. Ihr Nutzen beim lokal fortgeschrittenen
Prostatakrebs und auch in der Palliation bei fortgeschrittener/metastasierter Krankheit ist weithin
anerkannt. Doch zu den adjuvant hormonell behandelten Männern gehören vielfach auch jene mit lokalem
Prostatakarzinom im Frühstadium, bei denen ein Überlebensvorteil durch die ADT zumindest fraglich ist.
In solchen Fällen sind die negativen Auswirkungen eines massiven Hypogonadismus mit in die
Therapieentscheidung einzubeziehen.
-
Männer mit einem niedrigen Testosteronspiegel sind prädestiniert dafür, Insulinresistenz und einen
Diabetes mellitus Typ 2 zu entwickeln – oftmals als Komponente eines metabolischen Syndroms. Dieses
Risiko macht sich bei Prostatakrebs-Patienten unter einer ADT deutlich bemerkbar. Bei der Behandlung
mit einem GnRH-
Gegenüber gesunden altersangepassten Kontrollen hatten Männer mit nicht metastasiertem Prostatakrebs
nach zumindest 12-monatiger ADT signifikant höhere alters- und Body Mass Index (BMI)-
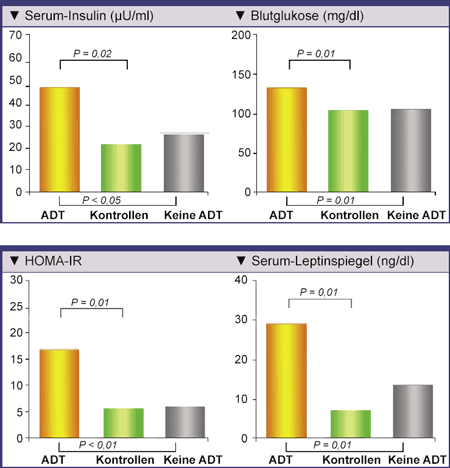
Abb. 1: Hyperinsulinämie, Hyperglykämie, Insulinresistenz [bestimmt als Homeostasis Model Assessment
for Insulin Resistance (HOMA-IR)], und Hyperleptineämie bei Männern mit Prostatakrebs, die sich einer
langfristigen Androgendeprivationstherapie (ADT) unterziehen (nach Basaria S, et al, 2006).
Neueste Ergebnisse zur Assoziation von Testosterondeprivation unter einer ADT, viszeralem Fett und
Glukosestoffwechsel berichtet eine interdisziplinäre australische Arbeitsgruppe [7]: Die
Prostatakrebs-
-
In den letzten Jahren wurde wiederholt gezeigt, dass ein niedriger Testosteronspiegel mit einem
ungünstigen Lipidprofil im Zusammenhang steht. Hyperlipidämie – insbesondere erhöhte Gesamtcholesterin-,
LDL- und Triglyzeridwerte – gehört zu den anerkannten Risikofaktoren für kardiovaskuläre Krankheiten
und Mortalität. Daten aus den westlichen Industrieländern zeigen, dass die Triglyzeridspiegel und das
Gesamtcholesterin unter der Behandlung mit einem GnRH-Agonisten um ca. 26% bzw. um ca. 10% ansteigen.
Erstaunlicherweise wurden auch um 8% bis 11% höhere Spiegel an HDL-Cholesterin berichtet [2].
Ähnliche Daten liegen auch für ostasiatische Bevölkerungen wie die Japans vor. Dort kommt der ADT eine
noch größere Bedeutung zu wie in den westlichen Industrieländern. Die hormonelle Therapie wird bei
Prostatakrebs in einem hohen Prozentsatz der Fälle primär eingesetzt. In der aktuell veröffentlichten
Studie einer japanischen Arbeitsgruppe wurde ein Anwachsen der Gesamtfettmasse und insbesondere des
viszeralen Fettes bei Prostatakrebs-Patienten unter einer ADT nach sechs Monaten ermittelt. Der Anstieg
setzte sich bis zum Ende der Untersuchung nach 12 Monaten fort. Parallel dazu erhöhten sich die Konzentrationen
an Gesamtcholesterin und LDL-Cholesterin signifikant [8].
-
Das metabolische Syndrom wird zwar unterschiedlich definiert, doch es kann allgemein als Anhäufung kardiovaskulärer
Risikofaktoren aufgefasst werden. Hierzu gehören zentrale Adipositas, Bluthochdruck, Dyslipidämie und wenig körperliche
Aktivität – jeweils in enger Beziehung zu Insulinresistenz.
In einer Querschnittsstudie wurden die Inzidenz des metabolischen Syndroms wie auch die verschiedener seiner Komponenten
bei drei Gruppen von Männern verglichen [9]. Zum einen hatten Patienten mit einem nicht metastasiertem Prostatakarzinom
für mindestens 12 Monate eine ADT erhalten. Die zweite Gruppe stellten Prostatakrebs-Patienten, die nach lokaler Therapie
einen PSA-Anstieg aufwiesen. Sie waren wie auch die altersangepassten Männer der Kontrollgruppe eugonadal. Bei den Männern
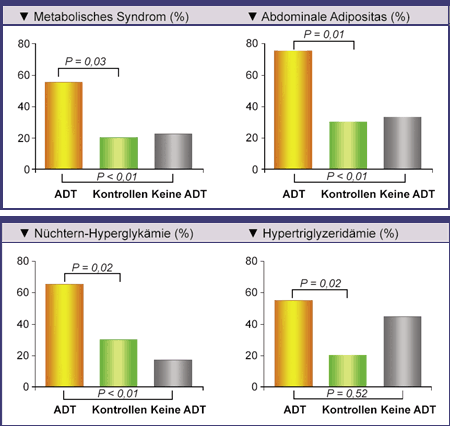
der ADT-Gruppe wurden deutlich häufiger ein metabolisches Syndrom, abdominale Adipositas, eine Hyperglykämie und eine
Hypertriglyzeridämie ermittelt als bei den Männern der anderen beiden Gruppen (Abb. 2). Die Unterschiede für LDL, HDL
und Hypertonie erreichten keine statistische Signifikanz. Bestimmende Faktoren für die Entwicklung eines metabolischen
Syndroms unter einer langfristigen ADT scheint abdominale Adipositas und Hyperglykämie zu sein.
|
Abb. 2: Prävalenz des metabolischen Syndroms und verschiedener seiner Komponenten bei
Prostatakrebs- |
Prostatakrebs-Patienten unter einer ADT gehören prinzipiell zum Personenkreis mit erhöhtem Risiko für das metabolische Syndrom [1]. Bei ihnen sollte nicht abgewartet werden bis sich Stoffwechselstörungen manifestieren und die Diagnose eines metabolischen Syndroms gesichert ist, sondern es ist sinnvoller, den Männern von vornherein durch Aufklärung und Beratung über den Nutzen einer adäquaten Lebensstilanpassung beiseite zu stehen. In diese Richtung zielt der Ansatz französischer und belgischer Urologen/Andrologen, die ein „Educational Tool-kit“ zur Ernährung und körperlichem Fitness-Training für Patienten, die mit einer ADT beginnen, entwickelt und in praxi getestet haben [10]. Die Autoren berichten über eine überwiegend positive Aufnahme durch Patienten und Ärzte.
-
Mit der ADT steht heute ein wesentlicher Grundstein für die Behandlung des Prostatakarzinoms – insbesondere
in der palliativen Situation – zur Verfügung. Es gilt jedoch „die falsche Anwendung und/oder den Missbrauch“
der ADT zu vermeiden [11]. Denn Androgene spielen in der Regulation der Fettverteilung, für die Insulinsensitivität
wie auch für den Lipid- und Knochenstoffwechsel eine essenzielle Rolle. Das spiegelt sich in einer Reihe von
Publikationen der letzten Jahre wider, die über eine erhöhte Gesamt- und kardiovaskuläre Morbidität wie auch
Mortalität im Zusammenhang mit der ADT berichten.
Literatur:
[1] Collier A, Ghosh S, McGlynn B, Hollins G, 2011. Prostate cancer, androgen deprivation therapy, obesity, the metabolic syndrome, Type 2 diabetes, and cardiovascular disease: a review. Am J Clin Oncol [Epub ahead of print].
[2] Saylor PJ, Smith MR, 2010. Adverse effects of androgen deprivation therapy: defining the problem and promoting health among men with prostate cancer. J Natl Compr Cancer Netw 8:211-223.
[3] Basaria S, 2008. Androgen deprivation therapy, insulin resistance and cardiovascular mortality: an inconvenient truth. J Androl 29:534-539.
[4] Shahani S, Braga-Basaria, Basaria S, 2008. Androgen deprivation therapy in prostate cancer and metabolic risk for atherosclerosis. J Clin Endocrinol Metab 93:2042-2049.
[5] Keating NL, O’Malley AJ, Smith MR, 2006. Diabetes and cardiovascular disease duringandrogen deprivation therapy for prostate cancer. J Clin Oncol 24:4448-4456.
[6] Basaria S, Muller DC, Carducci MA, et al. 2006. Hyperglycemia and insulin resistance in men with prostate carcinoma who receive androgen deprivation therapy. Cancer 106:581-588.
[7] Hamilton EJ, Gianatti E, Strauss BJ, et al. 2011. Increase in visceral and subcutaneous abdominal fat in men with prostate cancer treated with androgen deprivation therapy. Clin Endocrinol (Oxf) 74:377-383.
[8] Torimoto K, Samma S, Kagebayashi Y, et al. 2011. The effects of androgen deprivation therapy on lipid metabolism and body composition in Japanese patients with prostate cancer. Jpn J Clin Oncol [Epub ahead of print].
[9] Braga-Basaria M, Dobs AS, Muller DC, et al. 2006. Metabolic syndrome in men with prostate cancer undergoing long-term androgen-deprivation therapy. J Clin Oncol 24:3979-3983.
[10] Lebret T, Coloby P, Descotes JL, et al. 2010. Educational Tool-kit on diet and exercise: survey of prostate cancer patients about to receive androgen deprivation therapy. Urology 76:1424-1439.
[11] Corona G, Baldi E, Maggi M, 2011. Androgen regulation of prostate cancer: where are we now? J Endocrinol Invest Feb 4 [Epub ahead of print].
© 2003-2025 pro-anima medizin medien
–
impressum
–
mediadaten
–
konzeption
–
datenschutz
