
Lichtblick im Bereich der onkologischen Therapien
Die überwiegende Anzahl der Fälle von Hodenkrebs wird in einem frühen klinischen Stadium (CS I) diagnostiziert. Bei Seminomen im Stadium I reicht die Heilungsrate an 100% heran. Dabei spielt es keine Rolle, ob nach der Orchiektomie eine adjuvante Therapie oder Active Surveillance gewählt wird.
Active Surveillance ist beim Nichtseminom im Stadium I als Standardtherapie etabliert. Damit sind etwa 70% der Patienten nach der Orchiektomie ohne weitere Therapie geheilt. Ärzte und Patienten, die eine Risikoreduktion bevorzugen, können eine retroperitoneale Lymphadenektomie oder einen Zyklus BEP-Chemotherapie wählen. Bei einem Rezidiv müssen den Patienten drei oder vier Zyklen einer BEP-Chemotherapie gegeben werden. Die Heilungsquote beträgt insgesamt ca. 99%.
Hodentumoren im Stadium II werden entsprechend ihrer Tumorlast klassifiziert. Bei Seminomen und Nicht seminomen mit geringer Tumorlast liegen die Heilungsquoten bei 90-95% bzw. über 95%.
Auch bereits metastasierter Hodenkrebs – früher durchweg letal – kann heute in mehr als 80% der Fälle geheilt werden. Die jeweilige Chance der Heilung ist für den Patienten je nach Klassifizierung in die gute, intermediäre oder schlechte Prognosegruppe unterschiedlich aussichtsreich.
Testikuläre Keimzelltumoren sind die häufigste maligne Erkrankung bei Männern im Alter zwischen 15 und 35 Jahren.
Der Tumor wird bei etwa drei von vier Hodenkrebs-Patienten in einem frühen Stadium entdeckt. Diese Männer haben eine
krebsspezifische Überlebenschance die an nahezu 100% heranreicht. Im Allgemeinen spricht Hodenkrebs gut auf
Strahlentherapien wie auch platinhaltige Chemotherapien an und ist heute auch im metastasierten Stadium in mehr
als 80% der Fälle heilbar. Das kann als bedeutendster Erfolg moderner onkologischer Therapiestrategien
gewertet werden, auch wenn maligne testikuläre Keimzelltumoren immer noch eine nennenswerte Ursache der mit
medizinischer Behandlung im Zusammenhang stehenden Mortalität bei jungen kaukasischen Männern sind.
Aufgrund unterschiedlicher Behandlungsstrategien werden Keimzelltumoren des Hodens in die beiden
Hauptkategorien Seminome und Nichtseminome unterteilt. Zusammen repräsentieren
sie ca. 95% aller testikulären Tumoren. Von den malignen Tumoren, die nur aus einem Zelltyp bestehen,
sind etwa die Hälfte Seminome. Zur Kategorie der Nichtseminome gehören embryonale Karzinome, Teratome,
Chorionkarzinome und Dottersackkarzinome sowie die gemischten Tumoren.
Testikuläre Keimzelltumoren verkörpern eine diverse Gruppe von Tumoren, die nach heutiger Sichtweise
von sich entwickelnden Keimzellen aus der frühen Fetalzeit abstammen. Diese Hypothese des »fetalen
Ursprungs« geht von einer Fehlentwicklung bei der Differenzierung der fetalen Keimzellen aus.
Sie erklärt zugleich, dass Entwicklungsschritte, die die Pluripotenz oder Differenzierung der Keimzellen
regulieren, offenbar bei der malignen Transformation eine Rolle spielen. Ferner wird durch den
fetalen Ursprung der Keimzelltumoren deren Hypersensitivität gegenüber DNA-schädigenden Einwirkungen
(z. B. Strahlenexposition und Cisplatin-basierte Chemotherapie) verständlich. Zur Aufrechterhaltung
der genomischen Integrität werden Spontanmutationen unterdrückt und es fehlt ein G1-Checkpoint, so dass
Apoptosen begünstigt und dadurch Zellen mit Mutationslast ausgemerzt werden [1].
Somit macht die enge Verbindung zwischen dem Phänotyp der Stammzellkomponenten beim Hodenkrebse und
der totipotenten Vorläuferzelle (primordiale Keimzelle oder Gonozyt) Hodenkrebs aus onkofetaler
Sicht sehr bedeutsam [2].
Epidemiologie und ätiologische Faktoren
-
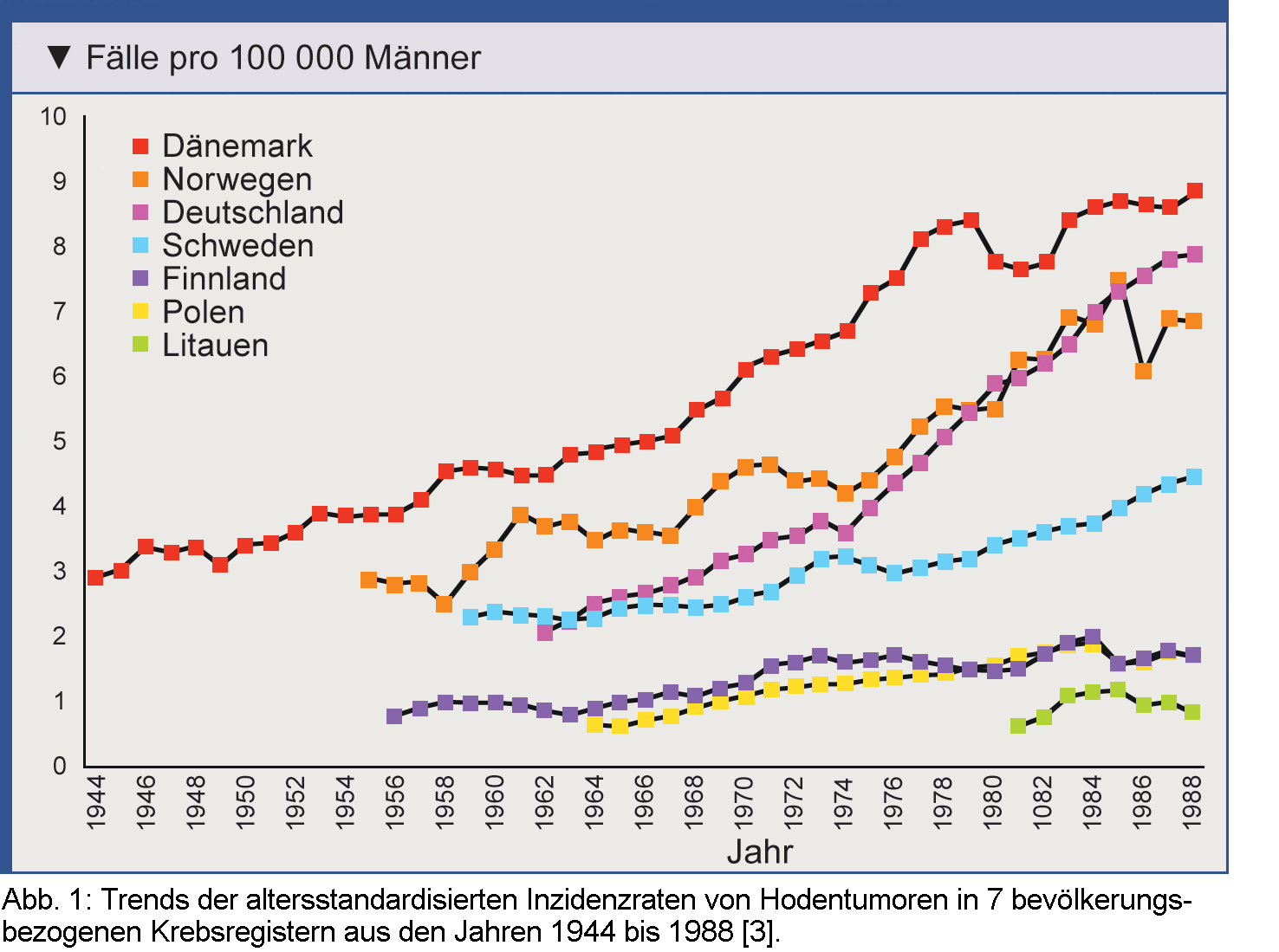
Maligne Keimzelltumoren des Hodens sind eine insgesamt seltene Krebserkrankung. In Deutschland waren
für das Jahr 2014 etwa 4.000 Neuerkrankungen prognostiziert worden. Die Inzidenz in den Industriestaaten
war zuvor nach der Mitte des 20. Jahrhunderts unerklärlicherweise angestiegen (Abb. 1)
[3]. Neuere Daten des Robert Koch Instituts zeigen jedoch, dass die altersstandardisierte
Erkrankungsrate in Deutschland zuletzt nahezu konstant geblieben ist.
Eine Causa des Hodenkrebses ist nicht sicher bekannt. Es wurden allerdings verschiedene Risikofaktoren identifiziert, die für testikuläre Keimzelltumoren prädestinieren oder mit diesen im Zusammenhang stehen. Als Contributio gilt insbesondere Kryptorchismus, durch den das Risiko für Hodenkrebs vier- bis achtfach erhöht ist. Dabei haben Männer, deren kryptorchider Hoden in der Bauchhöhle verblieben ist, das höchste Hodenkrebs-Risiko.
Zahlreiche Faktoren besitzen die Wertigkeit einer Correlatio: Beispielsweise wurde bei Männern,
die sich aufgrund Infertilität in ärztliche Behandlung begeben, ein im Vergleich zum
Bevölkerungsquerschnitt erhöhtes Risiko für Hodenkrebs ermittelt (multivariate Analyse:
HR, 2,8; 95% CI, 1,3-6,0). Daraus wird auf gemeinsame ätiologische Faktoren von Infertilität
und Hodenkrebs spekuliert [4].
-
Nach der Anamneseerhebung folgt bei der Abklärung eines Verdachts auf Hodenkrebs die körperliche Untersuchung.
Bei letzterer lassen sich Eigenschaften einer Raumforderung im Hoden ertasten. Die zugleich durchgeführte
allgemeine Untersuchung kann helfen, potenzielle supraklavikuläre Metastasen, Fernmetastasen, tastbare
abdominale Raumforderungen oder eine Gynäkomastie zu diagnostizieren.
Bildgebende Verfahren
Bei der sonographischen Untersuchung der Hoden lässt sich eine bis zu 95%ige Sicherheit der Diagnose erreichen.
Hodentumoren werden im homogenen Hodenparenchym typischerweise als inhomogene iso- oder hypoechogene Strukturen
abgebildet. Der Einsatz der Magnetresonanztomographie (MRT) in der Hodenkrebsdiagnostik ist schon aus
Kostengründen allenfalls gerechtfertigt, wenn suspekte Ultraschallbefunde unter Vermeidung eines Eingriffs
abgeklärt werden sollen.
Zum Nachweis retroperitonealer Lymphknotenmetastasen kann Ultraschall, bevorzugt aber eine Computertomographie (CT) des Bauchraums dienen. Anstelle der CT kann, sofern aus bestimmten Gründen erforderlich, eine MRT gemacht werden. Liegen keine retroperitonealen Metastasen vor, dient ein Röntgenthorax oder häufiger eine CT des Thorax dem Ausschluss von Lungenmetastasen.
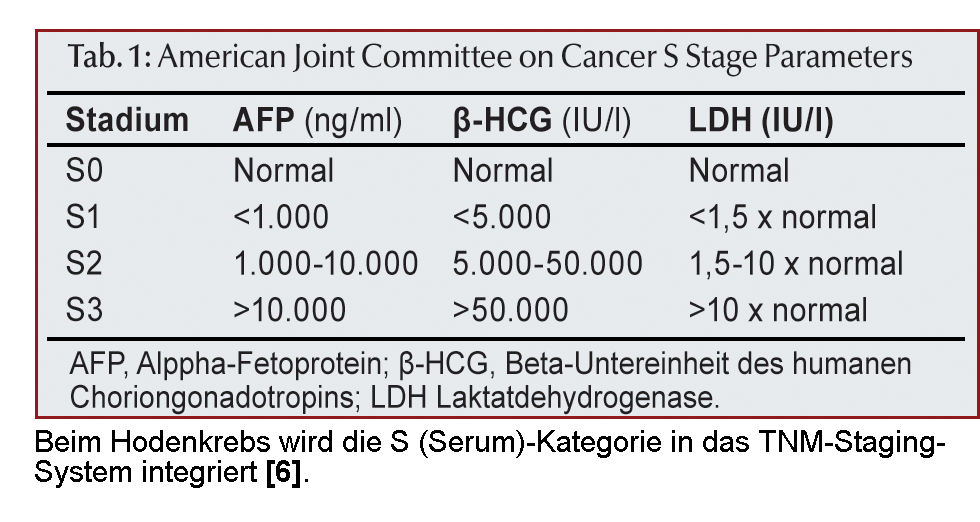
Serum-Tumormarker
Zur Diagnosestellung werden beim Hodenkrebs unter anderem die Tumormarker Alpha-Fetoprotein (AFP; mittlere
Serum-Halbwertzeit: 5-7 Tage), die Beta-Untereinheit des humanen Choriongonadotropins (β-HCG; mittlere
Halbwertszeit: 2-3 Tage) und die Laktatdehydrogenase (LDH) herangezogen. Diese Substanzen werden von
einigen Keimzelltumoren produziert und ins Blut abgegeben.
Massiv erhöhte β-HCG-Werte von mehr als 10.000 IU/l kommen nahezu ausschließlich bei Patienten mit Keimzelltumoren vor. Geringere Werte werden hingegen auch bei anderen Karzinomen (z.B. Bronchialkarzinom, Magenkarzinom) erreicht. Bei 40-60% der Patienten mit einem nicht-seminomatösen Keimzelltumor wird eine Erhöhung des β-HCG gemessen. Deutlich erhöhte Werte sind vor allem für embryonale Karzinome und Chorionkarzinome charakteristisch. Beim Seminom weist ein erhöhtes β-HCG auf synzytiotrophoblastäre Zellen im Tumorgewebe hin.
Alpha-Fetoprotein ist bei 50-70% der Patienten mit nicht-seminomatösem Keimzelltumor erhöht. Von reinen Seminomen wird AFP nicht produziert. Pathologisch erhöhte AFP-Werte findet man allerdings auch bei chronischen Lebererkrankungen, bei gastrointestinalen Tumoren und beim hepatozellulären Karzinom. Aber nur bei letzterem und bei Keimzelltumoren kommen Werte höher als 10 000 mg/l vor.
Die Laktatdehydrogenase (LDH) ist ein für Hodenkrebs sehr unspezifischer Marker. Dennoch kann LDH insbesondere beim fortgeschrittenen Seminom das Therapiemonitoring wie auch die sich anschließende Verlaufskontrolle sinnvoll unterstützen. Seine Korrelation mit der Tumormasse dient als prognostischer Faktor in der Beurteilung fortgeschrittener Tumoren.
Optional kann auch plazentare alkalische Phosphatase (PLAP) bestimmt werden. Ihre Verwendung liegt insbesondere in der Verlaufskontrolle von Patienten mit einem Seminom. Bei Rauchern ist aber an falsch positive PLAP-Werte zu denken.
Die Tumormarker werden vor Beginn einer adjuvanten Therapie oder der Surveillance bestimmt. Erhöhte Tumormarker alleine können eine Hodenkrebsdiagnose jedoch nicht absichern. Es gibt allerdings verschiedene klinische Szenarien bei denen die Patienten bei der Diagnosestellung deutlich erhöhte Tumormarker und symptomatische Metastasen aufweisen und eine Biopsie unter Umständen nicht ratsam ist (z. B. bei ausgedehnten Lungenmetastasen mit daraus resultierender Dyspnoe oder einer großen retroperitonealen Lymphadenopathie mit starken Schmerzen oder Ödemen). In solchen Fällen wird oft allein auf Grundlage der Tumormarker vor der Orchiektomie eine Chemotherapie gegeben. Damit verzögert sich die Therapie durch die Rekonvaleszenzzeit nach der Operation nicht [5].
Nach der Orchiektomie sind Neubestimmungen der Tumormarker zur Risikostratifizierung entsprechend
Die Durchführung einer kontralateralen Biopsie wurde auf einem Diskussionsforum mit Onkologen, urologischen
Chirurgen, Radioonkologen, Pathologen und Grundlagenforschern im November 2011 von 43,1% der Teilnehmer
nicht befürwortet, während 15,7%, 25,5% und 13,7% die Maßnahme entweder als optionale Untersuchung für
das Staging, bei High-risk-Keimzelltumoren bzw. generell bei allen Hodenkrebs-Patienten empfahlen [7].
-
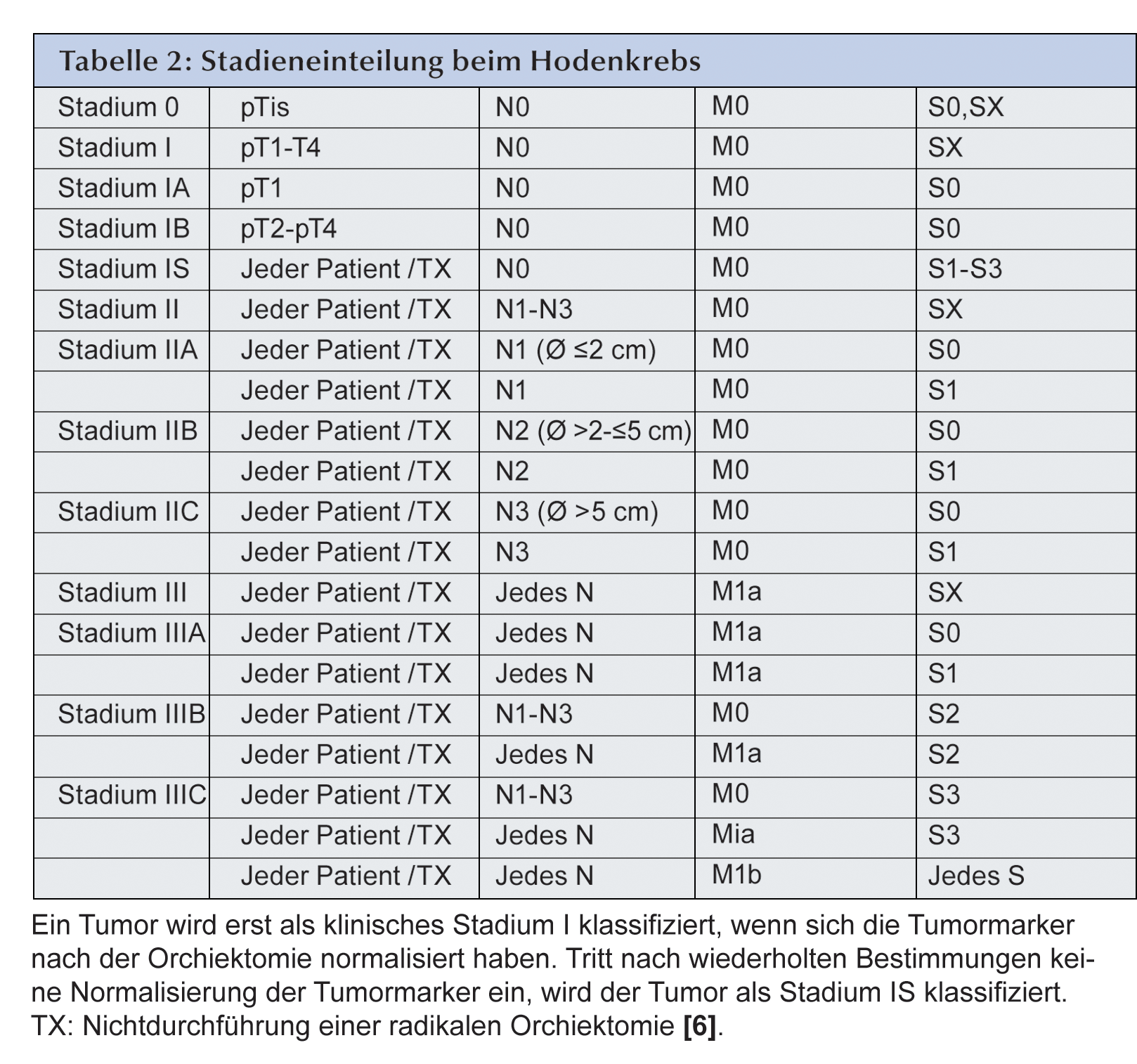
Die Stadieneinteilung beim Hodenkrebs erfolgt nach dem TNM-Staging-System. Als Besonderheit kommt bei
männlichen Keimzelltumoren die so genannte S (Serum)-Kategorie durch die Marker AFP, -HCG und LDH
hinzu (Tabelle 2):
- Stadium 0: Die testikuläre Intraepitheliale Neoplasie (TIN), synonym: Intratubuläre Keimzellneoplasie (pTis) ist die Frühform des Keimzelltumors bei dem anormale Zellen in den Tubuli seminiferi gefunden werden, die aber noch nicht in das umgebende Gewebe des Hodens vorgedrungen sind. Patienten mit einer TIN haben die 70%ige Wahrscheinlichkeit, innerhalb von sieben Jahren einen Hodentumor zu entwickeln. Die Spiegel der Tumormarker sind im normalen Bereich.
- Stadium 1: Es liegt Hodenkrebs vor, der nach der inguinalen Orchiektomie in S1A, S1B und SIS unterteilt wird.
- Im Stadium 1A ist der Krebs auf das Hoden- und Nebenhodengewebe beschränkt und kann auf die
Tunica albuginea übergegriffen haben. Alle Tumormarker sind im Normbereich.
- Im Stadium 1B hat der Krebs auf Blutgefäße oder Lymphgefäße des Hodens übergegriffen. Alle Tumormarker sind im Normbereich.
- Im Stadium IS sind nach der Orchiektomie entweder alle Tumormarker geringfügig erhöht, oder ein oder mehrere Tumormarker liegen moderat über der Norm. Nichtseminome im Stadium IS werden wie Nichtseminome im metastasierten Stadium behandelt.
- Stadium 2: Der Krebs wird nach Orchiektomie als IIA, IIB oder IIC eingestuft.
Die Tumormarker können jeweils normal (S0) oder leicht erhöht (S1) sein.
Im Stadium 2A sind die Durchmesser der Lymphknoten kleiner als 2 cm.
Im Stadium 2B liegt der Lymphknotendurchmesser zwischen 2 und 5 cm.
Im Stadium 2C messen Lymphknoten mehr als 5 cm. - Stadium 3: Bei metastasiertem Hodenkrebs wird die Unterteilung in 3A, 3B und 3C vorgenommen:
Im Stadium 3A liegen Metastasen in nicht regionalen Lymphknoten oder der Lunge vor.
Die Spiegel der Tumormarker sind normal (S0) oder leicht erhöht (S1).
Im Stadium 3B hat der Krebs entweder auf regionale Lymphknoten oder nicht regionale Lymphknoten bzw. die Lungenübergegriffen. In jedem Fall sind die Tumormarker moderat erhöht (S2).
Im Stadium 3C sind die Tumormarker bei gleichen Metastasen wie im Stadium 3B stark erhöht (S3), oder der Tumor hat auf andere Organe wie Leber oder Gehirn übergegriffen.
-
Am Anfang der Therapie steht die operative Entfernung des betroffenen Hodens. Nachfolgend sind bei
Patienten mit einem Seminom im Stadium I die paraaortische Strahlentherapie, ein Zyklus Carboplatin
oder eine Überwachungsstrategie (Surveillance) anerkannte Behandlungsmodalitäten. Bei der Frage, welche
der Optionen zu bevorzugen ist, ergab sich beim E-Voting auf der Third European Consensus Conference
on Diagnosis and Treatment of Germ Cell Cancer im November 2011 in Berlin ein uneinheitliches
Abstimmungsergebnis. Die einfache Mehrheit 30% der Diskussionsteilnehmer favorisierte die
Überwachungsstrategie ungeachtet bestehender Risikofaktoren. Eine kaum geringere Fraktion
mit 26% befürwortete Surveillance als Standard bei den Patienten mit niedrigem Risiko und sah
Carboplatin als die einzige alternative Strategie bei Patienten mit hohem Risiko. Einen ähnlichen
Standpunkt, jedoch mit Carboplatin und Strahlentherapie als alternative Optionen bei Patienten
mit hohem Risiko vertraten 22% der Teilnehmer. Immerhin 12% der Stimmen fielen auf die gleiche
Wertigkeit von Überwachung, adjuvantem Carboplatin und adjuvanter Strahlentherapie. Surveillance
und Carboplatin als gleichwertige Optionen ohne Berücksichtigung von Risikofaktoren waren für 10%
die bevorzugte Therapieentscheidung [7].
Adjuvante Strahlentherapie
In drei vom Medical Research Council (MRC) und der European Organisation for Research and Treatment
of Cancer (EORTC) durchgeführten Noninferioritätsprüfungen (TE10, TE18 und TE19) waren verschiedene
Strahlentherapie-Regime bei Patienten mit einem Seminom im Stadium I verglichen worden.
In TE10 wurde untersucht, ob das Bestrahlungsfeld vom standardmäßigen „dog leg field“ (paraaortale
Lymphknoten plus ipsilaterale Beckenlymphknoten) auf das paraaortale Feld reduziert werden kann.
Nach einem medianen Follow-up von 10,7 Jahren ergab sich für Rezidive insgesamt ein Hazard
Ratio (HR) von 1,15 (95% CI 0,54- 2,44) [8]. Aus TE10 folgern die Autoren, dass bei Patienten
mit einem testikulären Seminom im Stadium I (T1-T3) und ungestörter Lymphdrainage eine adjuvante
Strahlentherapie auf das paraaortale Feld reduziert werden kann und empfehlen diese als Standardbehandlung.
Vorteilhaft ist insbesondere auch die geringere hämatologische, gastrointestinale und gonadale Toxizität.
Andererseits ist das Risiko für pelvine Rezidive geringfügig erhöht – bei allerdings niedriger
Rezidivrate für beide Bestrahlungsfelder [9].
In TE18 und teilweise mit Patienten in TE19 wurde die Noninferiorität einer Bestrahlung von 20 Gy in 10 Fraktionen gegenüber einer Bestrahlung von 30 Gy in 15 Fraktionen nachgewiesen [8].
Adjuvante Chemotherapie
Beim Vergleich von einem Zyklus Carboplatin (Dosis 7 x AUC [Area Under Curve]) mit adjuvanter
Strahlentherapie (30 Gy in 15 Fraktionen bzw. 20 Gy in 10 Fraktionen) in der MRC/EORTC-Studie TE19 ergaben
sich hinsichtlich der Rezidivrate, der Zeit bis zum Rezidiv und des Hodenkrebs-spezifischen Überlebens
(medianes Follow-up: 6,5 Jahre) keine signifikanten Unterschiede [10]. Damit bestätigen
die ausgereiften Daten aus drei randomisierten Studien, dass beide Therapieregime – Strahlentherapie und
Carboplatin – für die adjuvante Therapie von Seminomen im Stadium I adäquat geeignet sind [8].
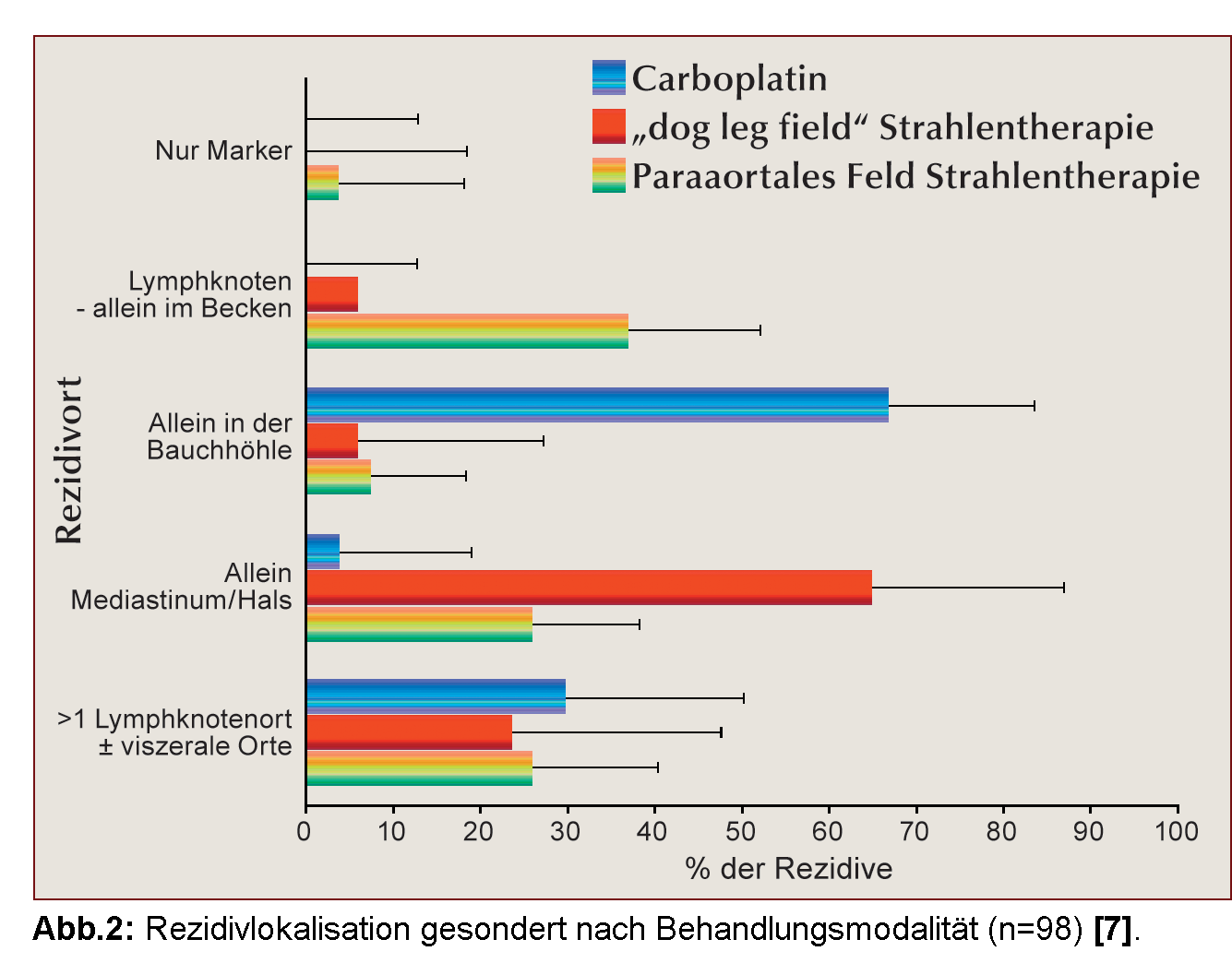
In den drei MRC/EORTC-Studien TE10, TE18 und TE19 mit insgesamt 2.466 Patienten kam es in insgesamt 98 Fällen zur Rezidivierung des ursprünglichen Tumors. Nur bei vier Patienten trat das Rezidiv später als drei Jahre nach der Behandlung auf – bei drei Männern, die bestrahlt worden waren, nach 61, 64 und 91 Monaten sowie bei einem Patienten mit Carboplatin-Behandlung nach 50 Monaten. Es bestand eine auffällige Variation der Rezidivlokalisation je nach Behandlungsmethode und Bestrahlungsfeld (Abb. 2). Rezidive nach Strahlentherapie treten zunächst überwiegend außerhalb des Bestrahlungsfeldes (in supradiaphragmatischen Lymphknoten oder den Lungen) auf [10].
Active Surveillance
Während der letzten beiden Jahrzehnte wurden verschiedene prospektive Surveillance-Studien durchgeführt.
In einem umfassenden systematischen Review aus dem Jahr 2007 trugen im Wesentlichen Beobachtungsstudien
und nicht-experimentelle Vergleichsstudien zur Ermittlung der Effektivität in Surveillance-Programmen bei:
Rezidive traten bei ca. 28% und 17% der Nichtseminome bzw. Seminome auf. Die Hodenkrebs-spezifische
Überlebensrate lag bei 98% bzw. 100% [11].
In einer amerikanischen Studie jüngeren Datums wurde bei Patienten unter Active Surveillance im Vergleich zu denen mit Strahlenbehandlung oder Chemotherapie eine signifikant niedrigere Rate an rezidivfreiem Überleben registriert. Durch erfolgreiche Salvage-Therapie ergab sich bezüglich Gesamt- und krankheitsspezifischem Überleben jedoch kein Unterschied zwischen den Therapieoptionen [12].
Risikoadaptiertes Vorgehen
Als Kriterien für die Identifizierung von Hoch-Risiko-Patienten mit einem Seminom im Stadium I gelten
weithin eine Tumorgröße >4 cm und die Rete-testis-Invasion. Andererseits konnten diese Risikofaktoren
in einer prospektiven, bevölkerungsbasierten Untersuchung der Swedish Norwegian Testicular Cancer
(SWENOTECA)-Studiengruppe nicht verifiziert werden [13]. Im Gegensatz hierzu wurde die Wertigkeit
obiger Faktoren zur risikoadaptierten Therapie bei Patienten mit einem Seminom im Stadium I von der
spanischen Germ Cell Cancer Group bestätigt. Adjuvantes Carboplatin erwies sich als angemessene
Behandlungsoption für Patienten mit zwei Risiken und Active Surveillance bei Vorliegen von nur
einem oder keinem der Risikofaktoren [14].
-
Nach der Orchiektomie ist bei Nichtseminomen im Stadium I ein risikoadaptiertes Vorgehen sowohl mit
Active Surveillance, primärer Chemotherapie als auch nervschonender retroperitonealer Lymphknotendissektion (RPLND)
richtlinienkonform [15]. Letztere Therapieform hat sich in letzter Zeit im Wesentlichen auf Fälle reduziert,
in denen – aus welchen Gründen auch immer – eine der ersten beiden Optionen nicht in Frage kommt.
Active Surveillance
Die Surveillance-Strategie hat sich beim Nichtseminom im Stadium I bereits seit längerem etabliert.
In einer kanadisch/US-amerikanischen Studie wurde nahezu 75% der Patienten mit Nichtseminom im Stadium I bei nicht risikoadaptierter Surveillance nach der Orchiektomie jegliche weitere Therapie erspart. Die Untersucher werteten Active Surveillance für alle Patienten mit Nichtseminom im Stadium I als mit ausgezeichneten Krankheitsergebnissen verbunden, vergleichbar denen, die für die primäre retroperitoneale Lymphknotendissektion (RPLND) oder die adjuvante Chemotherapie berichtet werden [16].
Aktuell berichtete eine dänische Arbeitsgruppe die Krankheitsergebnisse der Patienten mit Nichtseminom im Stadium I (einschließlich High-risk-Patienten mit vaskulärer Invasion) ohne den Nachweis disseminierter Tumorzellen in einer großen Fallserie: Es ereigneten sich bei 1.226 Teilnehmern insgesamt 382 Rezidive (31,2%). Die Rate des 15 Jahre krankheitsspezifischen Überlebens erreichte 99,1% [17] (siehe auch Referat S. 13).
In einer randomisierten Studie wurde geprüft, ob die Rezidivrate bei Patienten mit Nichtseminom im Stadium I unter Surveillance durch zwei gegenüber fünf CT-Scans nachteilig beeinflusst wird. Dabei wurde mit 95%iger Sicherheit ausgeschlossen, dass sich die Rezidivrate um mehr als 1,6% erhöht, wenn das Surveillance-Protokoll zwei statt fünf CT-Scans nach der Orchiektomie vorsieht. Bei Low-risk-Patienten können demnach CT-Scans drei und 12 Monate nach der Orchiektomie als angemessene Option betrachtet werden [18].
Adjuvante Chemotherapie mit BEP
Als adjuvante Chemotherapie beim Nichtseminom im Stadium I galten lange Zeit zwei dreiwöchige Zyklen einer Bleomycin, Etoposid und Cisplatin (BEP)-Chemotherapie als erforderlich. Heute wird jedoch vielfach bevorzugt nur ein Zyklus verabreicht. Dies hat sich als vergleichbar effektiv erwiesen, und reduziert die Rezidivrate von 30% auf weniger als 3%.
In einer großen randomisierten Studie zu adjuvanten Therapiestrategien beim nicht seminomatösen
Keimzelltumor im klinischen Stadium I wurde Die Überlegenheit eines einzelnen BEP-Zyklus gegenüber
einer nach allgemeinen Standards durchgeführten RPLND in Bezug auf die Rezidivprävention nachgewiesen.
Obwohl es sich nicht um eine Standardtherapie handelt, ist ein BEP-Zyklus in einer unselektionierten
Patientengruppe im klinischen Stadium I aktiv [19].
-
Hodenkrebs-Patienten die unter Surveillance ein Rezidiv erleiden, haben eine 99%ige Heilungschance,
wenn sie sich anschließend einer Chemotherapie mit Bleomycin, Etoposid und Cisplatin unterziehen.
Hiermit haben alle Patienten, gleich welche Initialtherapie (Surveillance, Strahlentherapie,
adjuvantes Carboplatin) sie erhalten, das gleiche krebsspezifische Überleben, argumentieren
Verfechter einer Surveillance-Strategie für sämtliche Patienten mit einem Hodenkrebs im Stadium I.
Zugleich bleibt 70 bis 85% der Patienten ohne Rezidiv eine adjuvante Therapie erspart. Bei einem
Rezidiv müssen die Patienten allerdings ganze drei oder vier Zyklen einer BEP-Chemotherapie in
Kauf nehmen. Insofern wäre die adjuvante Therapie eine Versicherung gegen die Salvage-Therapie
und kann nicht von vornherein als unnötig abgetan werden. Allerdings deckt eine solche Versicherung
nicht das ganze Risiko der Rezidivierung ab. Die Rezidivrate wird lediglich auf ca. 2% reduziert.
Der hauptsächliche Nachteil der Surveillance-Programme liegt in der Notwendigkeit eines aufwendigeren Überwachungsprotokolls mit wiederholten bildgebenden Untersuchungen zur Entdeckung retroperitonealer Lymphknoten, für mindestens fünf Jahre nach der Orchiektomie. Das geringe aber klinisch signifikante Risiko eines Rezidivs mehr als fünf Jahre nach der Orchiektomie bedingt die Notwendigkeit der langfristigen Surveillance.
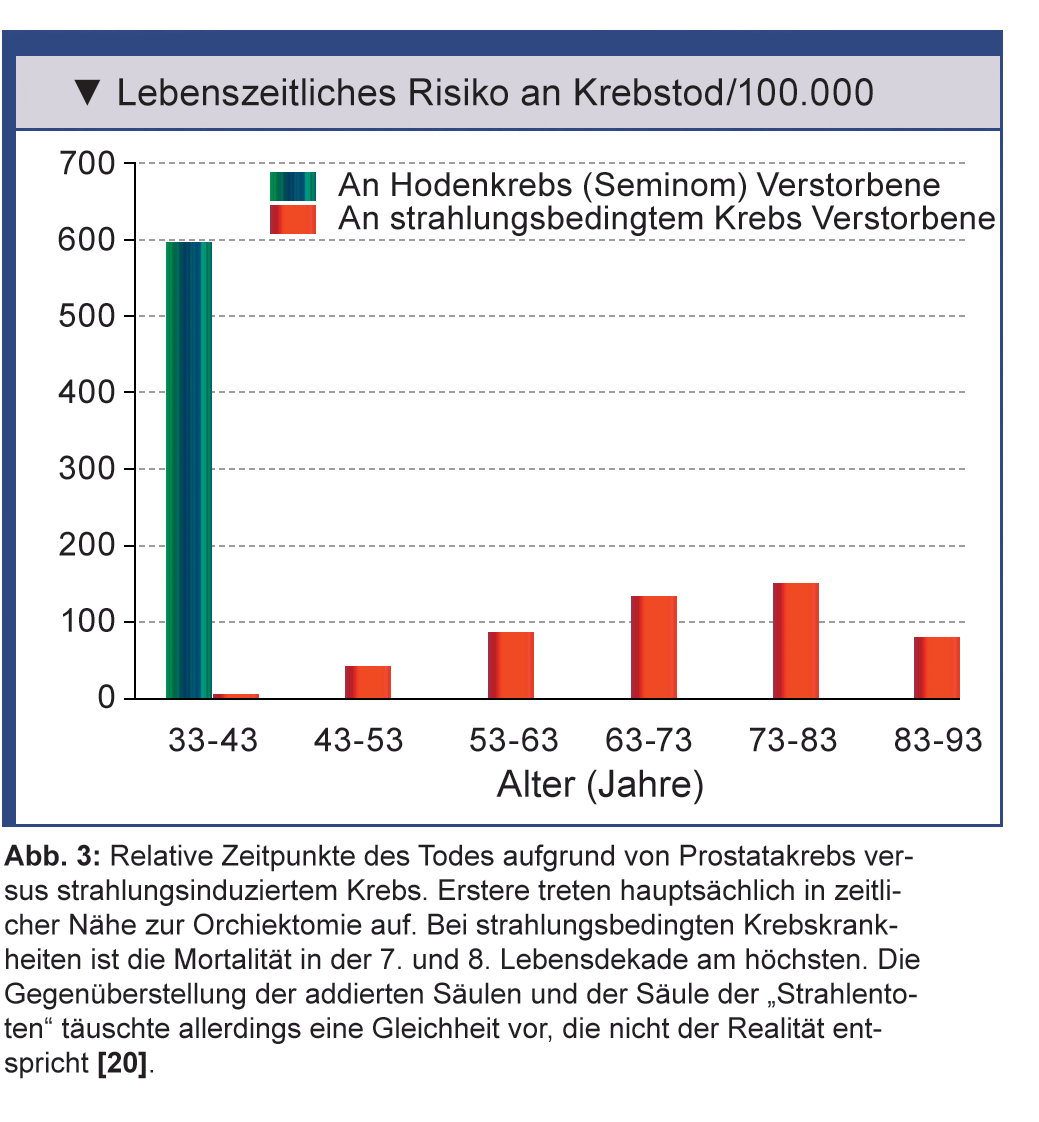
Die Compliance der Patienten unter Surveillance wurde in verschiedenen Untersuchungen
unterschiedlich von schlecht bis angemessen gut beurteilt. Allerdings konnten diesbezüglich
keine Auswirkungen auf das klinische Krankheitsergebnis nachgewiesen werden. Dem Gesichtspunkt
der Wirtschaftlichkeit einzelner als äquivalent geltender Behandlungsmethoden ist zunehmend
ebenfalls Rechnung zu tragen. In einer Kostenanalyse für Seminome im Stadium I wurde
Surveillance mit adjuvanten Therapien verglichen. Dabei waren die Strahlentherapie
der paraaortalen Lymphknoten alleine oder zusammen mit den ipsilateralen Beckenlymphknoten
[dog leg field] wie auch ein Zyklus Carboplatin gegenüber der Surveillance deutlich
kosteneffektivere Behandlungsoptionen. Andererseits reduzieren sich die Kosten für
Surveillance durch Einsparungen an zusätzlichen Therapiekosten nach der Orchiektomie
bei 80-85% der Patienten. Keinesfalls sind solche Kosten- Erstattungsargumente aber geeignet,
das klinisch begründete Urteilsvermögen zu verdrängen [21].
-
Patienten mit einem Nichtseminom im Stadium IIA/B (retroperitoneale Lymphknoten bis 2 cm (Stadium A) oder 2–5 cm
(Stadium B) können in bis zu nahezu 98% der Fälle geheilt werden.
Nach der radikalen inguinalen Orchiektomie wird die weitere Behandlung von den dann gemessenen Spiegeln der Tumormarker abhängig gemacht. Sind diese anhaltend erhöht, erfolgt gewöhnlich eine Chemotherapie, wie sie bei metastasierten Nichtseminomen im Stadium III angewandt wird. Bei normalisierten Spiegeln der Tumormarker richtet sich die Behandlung im Wesentlichen nach der Stadieneinteilung in IIA, IIB und IIC.
Im Allgemeinen unterziehen sich Patienten mit einem Nichtseminom im Stadium IIA einer retroperitonealen Lymphadenektomie (RPLND). Dessen Befund führt bei einem erheblichen Prozentsatz der Patienten zu einer Rückstufung in das Stadium I. Damit erübrigt sich auch für zahlreiche Patienten die Inkaufnahme einer Chemotherapie. Andererseits wird die Bevorzugung der RPLND als primäre Therapie bei Nichtseminomen im Stadium IIA auch durch die geringe Rate an systemischer Progression und einer 22%igen Inzidenz retroperitonealer Teratome begründet [22].
Bei Patienten im Stadium IIB und IIC ist die Rückfallquote nach RPLND deutlich höher, so dass auch
gegen mögliche Metastasen bevorzugt mit einer systemischen Chemotherapie behandelt wird. Allerdings
sind das empirische Entscheidungen, da bei Patienten mit Nichtseminom im Stadium II keine randomisierte
Studie zu RPLND versus Chemotherapie gemacht worden ist.
-
Bei geringer Tumorlast (CS IIA/B) können Patienten in mehr als 95% der Fälle geheilt werden. Die Bestrahlung
der paraaortalen und hoch gelegenen ipsilateralen, iliakalen Lymphknoten gilt seit Längerem als eine
Standardtherapie. Hierbei wird mit Gesamtdosen von 30 Gy für CS IIA und 36 Gy für CS IIB bei Seminomen
im Stadium IIA/B eine ausgezeichnete Tumorkontrolle mit einer geringen Rate an Akut- und Spättoxizität
erzielt [23].
Für Patienten mit einem Seminom im Stadium IIA oder IIB stellt die Chemotherapie mit 3 Zyklen PEB oder 4 Zyklen PE eine Alternative zur Strahlentherapie dar [13, 24], die zumindest bei Tumoren im klinischen Stadium IIB weitgehend präferiert wird [7].
Die Behandlung der Seminome im Stadium IIA/B mit Carboplatin wäre insbesondere aufgrund dessen geringerer Toxizität sehr attraktiv. In einer Pilotstudie der German Testicular Cancer Study Group (GTCSG) ließen sich retroperitoneale Metastasen, durch drei bis vier Zyklen einer Carboplatin-Monochemotherapie allerdings nicht sicher ausmerzen [25].
Patienten mit einem Seminom im Stadium IIC sind keine Kandidaten für eine Strahlentherapie. Sie erhalten
nach der Orchiektomie eine Chemotherapie mit drei oder vier Zyklen BEP oder bei Bedenken gegen
Bleomycin alternativ vier Zyklen EP.
-
Patienten mit einem metastasiertem Seminom oder Nichtseminom werden anhand des Prognosesystems
In einer Studie der Australian and New Zealand Germ Cell Trials Group waren zwei BEP-Regime ‚Indiana-BEP‘ (3 Zyklen mit B90, E500, P vs. 4 Zyklen mit B30, E360, P) bei Patienten mit nach modifizierten Memorial-Sloan-Kettering-Kriterien überwiegend guter Prognose miteinander verglichen worden. Das mediane follow-up betrug 8,5 Jahre. In der Gruppe mit 3 Zyklen B90, E500, P war das Gesamtüberleben gegenüber der Gruppe mit 4 Zyklen B30, E360, P deutlich besser (8-Jahres-Überlebensraten: 92% bzw. 83%). Das progressionsfreie Überleben zeigte Vorteile für 3B90, E500, P, unterschied sich aber nicht signifikant zwischen den Behandlungsgruppen [28]. Liegt eine Kontraindikation gegen Bleomycin vor, können stattdessen vier Zyklen PE eingesetzt werden
. Bei Patienten mit metastasiertem Nichtseminom wird in etwa 25% der Fälle ein intermediäres Risikoprofil ermittelt. Von ihnen können 80% mit vier Zyklen einer BEP-Chemotherapie und der operativen Entfernung jeglicher verbliebenen Tumorlast geheilt werden. Von den metastasierten Seminomen werden ca. 10% mit intermediärem Risiko behaftet eingestuft. Bei ihnen wird ebenfalls mit vier Zyklen BEP behandelt.
Etwa 15% der metastasierten Nichtseminome sind mit einer schlechten Prognose behaftet. Auch bei diesen Fällen werden ca. 50 bis 70% durch die Chemotherapie mit vier Zyklen BEP und der chirurgischen Entfernung aller residuellen Tumoren geheilt. Ist bei Patienten mit intermediärer oder schlechter Prognose die Gabe von Bleomycin kontraindiziert, kann die Chemotherapie mit Etoposid, Ifosfamid und Cisplatin (VIP) mit ebenfalls guten Erfolgen eingesetzt werden.
Bei Patienten mit einem Nichtseminom ist in ca. 15 bis 30% der Fälle nach der Chemotherapie eine
Residualtumorresektion erforderlich. Hingegen ist das bei Patienten mit einem Seminom zumeist nicht der Fall.
Literatur:
[1] Hong Y, Stambrook PJ, 2004. Restoration of an absent G1 arrest and protection from apoptosis in embryonic stem cells after ionizing radiation. PNAS 101:14443-14448.
[2] Rijlaarsdam MA, Looijenga LHJ, 2014. An oncofetal and developmental perspective on testicular germ cell cancer. Semin Cancer 29:59-74. [3] Huyghe E1, Matsuda T, Thonneau P, 2003. Increasing incidence of testicular cancer worldwide: a review. J Urol 170:5-11.
[4] Walsh TJ, Croughan MS, Schembri M, et al. 2009. Increased risk of testicular germ cell cancer among infertile men. Arch Intern Med 169:351-356.
[5] Milose JC, Filson CP, Weizer AZ, et al. 2012. Role of biochemical markers in testicular cancer: diagnosis, staging, and surveillance. Open Access Journal of Urology 4:1–8.
[6] Albers P (chair), Albrecht W, Algaba F, Bokemeyer C, Cohn-Cedermark G, Fizazi K, Horwich A, Laguna MP, Nicolai N, Oldenburg J, 2014. EAU Guidelines on Testicular Cancer. http:// www.uroweb.org/guidelines/online-guidelines/
[7] Beyer J, Albers P, Altena R, et al. 2013. Maintaining success, reducing treatment burden, focusing on survivorship: highlights from the third European consensus conference on diagnosis and treatment of germ-cell cancer. Ann Oncol 24:878-888.
[8] Mead GM, Fossa SD, Oliver RTD, et al. 2011. Randomized trials in 2466 patients with stage I seminoma: patterns of relapse and follow-up. J Natl Cancer Inst 103:241-249.
[9] Fosså SD, Horwich A, Russell JM, et al. 1999. Optimal planning target volume for stage I testicular seminoma: A Medical Research Council Testicular Tumor Working Group randomized trial. J Clin Oncol 17:1146.
[10] Oliver RTD, Mead GM, Rustin GJ, et al. 2011. Randomized trial of carboplatin versus radiotherapy for stage I seminoma: mature results on relapse and contralateral testis cancer rates in MRC TE19/EORTC 30982 study (ISRCTN27163214). J Clin Oncol 29:957-962.
[11] Groll R J, Warde P, Jewett M A, 2007. A comprehensive systematic review of testicular germ cell tumor surveillance. Critical Reviews in Oncology/Hematology 64:182-197.
[12] Soper MS, HastingsJR, Cosmatos HA, et al. 2014. Observation versus adjuvant radiation or chemotherapy in the management of stage I seminoma: clinical outcomes and prognostic factors for relapse in a large US cohort. Am J Clin Oncol 37:356-359.
[13] Tandstad T, Smaaland R, Solberg A et al. 2011. Management of seminomatous testicular cancer: a binational prospective population-based study from the Swedish Norwegian testicular cancer study group. J Clin Oncol 29:719-725.
[14] Aparicio J, Maroto P, del Muro XG et al. 2011. Risk-adapted treatment in clinical stage I testicular seminoma: the third Spanish germ cell cancer group study. J Clin Oncol 29:4677-4681.
[15] Heidenreich A, Pfister D, 2012. Retroperitoneal lymphadenectomy and resection for testicular cancer: an update on best practice. Ther Adv Urol 4:187-205.
[16] C. Kollmannsberger C, Moore C, Chi KN, et al. 2010. Non-risk-adapted surveillance for patients with stage I nonseminomatous testicular germ cell tumors: diminishing treatment-related morbidity while maintaining efficacy. Ann Oncol 21:1296-1301.
[17] Daugaard G, Gundgaard MG, Mortensen MS, et al. 2014. Surveillance for stage I nonseminoma testicular cancer: outcomes and long-term follow-up in a population-based cohort. J Clin Oncol 32:3817-3823.
[18] Rustin GJ, Mead GM, Stenning SP, et al. 2007. Randomized trial of two or five computed tomography scans in the surveillance of patients with stage I nonseminomatous germ cell tumors of the testis: Medical Research Council Trial TE08, ISRCTN56475197– the National Cancer Research Institute Testis Cancer Clinical Studies Group. J Clin Oncol 25:1310-1315.
[19] Albers P, Siener R, Krege S, et al. 2008. Randomisierte Phase-III-Studie zu retroperitonealer Lymphknotendissektion vs. einem einzelnen Chemotherapie-Zyklus mit Bleomycin und Etoposid plus Cisplatin in der adjuvanten Therapie nichtseminomatöser testikulärer Keimzelltumoren im klinischen Stadium I: die AUO-Studie AH 01/94 der Deutschen Hodenkrebs-Studiengruppe. J Clin Oncol 26:2966-2972.
[20] Pandharipande PV, Eisenberg JD, Lee RL, et al. 2013. Patients with testicular cancer undergoing CT surveillance demonstrate a pitfall of radiation-induced cancer risk estimates: the timing paradox. Radiology 266:896-904.
[21] Cox JA, Gajjar SR, Lanni TB Jr, Swanson TA, 2015. Cost analysis of adjuvant management strategies in early stage (stage I) testicular seminoma. Res Rep Urol 7:1-7.
[22] Stephenson AJ, Bosl GJ, Motzer RJ, et al. 2005. Retroperitoneal lymph node dissection for nonseminomatous germ cell testicular cancer: impact of patient selection factors on outcome. J Clin Oncol 23:2781-2788.
[23] Classen J, Schmidberger H, Meisner C, et al. 2003. Radiotherapy for stages IIA/B testicular seminoma: final report of a prospective multicenter clinical trial. J Clin Oncol 21:1101-1106.
[24] Garcia-del-Muro X, Maroto P, Gumà J, Sastre J, et al. 2008. Chemotherapy as an alternative to radiotherapy in the treatment of stage IIA and IIB testicular seminoma: a Spanish Germ Cell Cancer Group Study. J Clin Oncol 26:5416-5421.
[25] Krege S, Boergermann C, Baschek R, et al. 2006. Single agent carboplatin for CS IIA/B testicular seminoma. A phase II study of the German Testicular Cancer Study Group (GTCSG). Ann Oncol 17:276-280.
[26] International Germ Cell Cancer Collaborative Group. 1997. International germ cell consensus classification: a prognostic factor-based staging system for metastatic germ cell cancers. J Clin Oncol 15:594-603.
[27] van Dijk MR, Steyerberg EW, Habbema JD, 2006. Survival of non-seminomatous germ cell cancer patients according to the IGCC classification: An update based on meta-analysis. Eur J Cancer 42:820-826.
[28] Grimison PS, Stockler MR, Thomson DB, et al. 2010. Comparison of two standard chemotherapy regimens for good-prognosis germ cell tumors: updated analysis of a randomized trial. J Natl Cancer 102:1253-6212.
© 2003-2025 pro-anima medizin medien
–
impressum
–
mediadaten
–
konzeption
–
datenschutz
