
Bedeutung der differenzierten Befundung und Dokumentation chirurgischer Schnittränder
Der Anteil positiver Schnittränder bei der radikalen Prostatektomie steht im Zusammenhang mit chirurgischer Routine – respektive dem Operationsvolumen einer Klinik. Sie werden einhellig als negatives Operationsergebnis gewertet. Die onkologischen Konsequenzen positiver Schnittränder wurden überwiegend anhand der erhöhten Rate biochemischer Rezidive beurteilt. Darin begründet sich die Indikation für eine adjuvante Strahlentherapie nach der radikalen Prostatektomie. Als Alternative wird der frühen Salvage-Strahlentherapie verschiedentlich der Vorzug gegeben. In jüngeren Studien mit längerem Follow-up ließ sich auch erhöhte Prostatakrebs-spezifische Mortalität im Zusammenhang mit positiven Schnitträndern nachweisen. Ferner wird der differenzierteren Untersuchung positiver Schnittränder zunehmend Bedeutung beigemessen. Verschiedene Variable positiver Schnittränder wie Lokalisation, Ausdehnung und Gleason-Grad sowie knappe Resektionsränder haben prognostische Relevanz.
Mit der radikalen Prostatektomie wird das Ziel einer kurativen Behandlung durch vollständiges Entfernen des Tumors aus gesundem Gewebe angestrebt. Die operative Behandlung ist deshalb insbesondere bei Tumoren geeignet, die sich sehr wahrscheinlich restlos entfernen lassen. Das Qualitätsmerkmal hierfür sind tumorfreie d. h. negative Schnittränder. Gelingt das nicht entsteht durch die resultierenden positiven Schnittränder eine Grauzone zwischen organbegrenztem und organüberschreitendem Tumor. Dessen prognostische Relevanz wird aufgrund des Zusammenhangs mit biochemischem Rezidiv durchweg als nachteiliges onkologisches Ergebnis gewertet [1]. In den letzten Jahren haben sich die Modalitäten und das Aufkommen der radikalen Prostatektomie erheblich gewandelt und führen zu differenzierterer onkologischer Bewertung positiver Schnittränder [2]. In diese Richtung zielt auch die Einbeziehung verschiedener Variabler positiver Schnittränder wie Lokalisation, Ausdehnung, Tumorgrad und knapper Resektionsrand in die Bewertung als pathologischer Risikofaktor nach radikaler Prostatektomie [3].
-
Trotz aller Bedeutsamkeit der funktionellen Operationsergebnisse für Prostatakrebs-Patienten nach radikaler
Prostatektomie, bleibt das vorrangige Ziel der chirurgischen Behandlung die vollständige Eradikation der
Krebsgeschwulst. Daher deuten Krebszellen, die auf dem Resektionspräparat bis an die mit Tinte markierte
Schnittfläche heranreichen, auf eine lokal unvollständige Entfernung des Tumors hin. Solche positiven
Schnittränder können als suboptimale operative Behandlung gewertet werden. Neben einer Untersuchung in
der alleinig das Vorliegen oder Nichtvorliegen positiver Schnittränder als Prädiktor klinisch relevanter
biochemischer Rezidive bei Gleason 7-Prostatakarzinomen ermittelt wurde [4], gibt es zahlreiche Studien zur
prognostischen Relevanz verschiedener Schnittrandvariabler – Lokalisation, Ausdehnung, Tumorgrad und
knapper Resektionsrand [3].
-
Der Prostata fehlt insbesondere im apikalen Bereich eine präzise abgegrenzte Kapsel. Zudem ist die stellenweise
sehr enge Nachbarschaft zu anderen Organen eine operationstechnische Herausforderung. Diese zu bewältigen stellt
hohe Anforderungen an die chirurgische Expertise, deren Vervollkommnung am ehesten in High-Volume-Zentren zu erlangen ist.
Als iatrogene Ursache für positive Schnittränder kommt in erster Linie das nicht beabsichtigte Einschneiden in einen intrapros-tatischen Tumor in Frage (pT2+). Solche „Ausrutscher“ Bereich der neurovaskulären Bündel lassen sich im in erster Linie auf das Bemühen zurückführen, dem Patienten die erektile Funktionsfähigkeit bewahren zu wollen. Aber die Krebszellen erreichen unmittelbar die im Präparat durch Tinte markierte Schnittfläche, und es kann somit nicht ausgeschlossen werden, dass residuelle Tumorzellen in situ verblieben sind. Eine weitere Möglichkeit für iatrogen verursachte Schnittränder wäre der Schnitt durch einen Bereich mit extraprostatischer Ausbreitung des Tumors. Um das zu vermeiden, blieben dem Chirurgen nur noch minimale Spielräume, um den Tumor durch erweitertes Ausschneiden komplett zu entfernen. Denn hat der Tumor die Kapsel bereits durchbrochen, sind positive Schnittränder kaum zu vermeiden und nicht iatrogen, da mit weitergehender Exzision des Tumors das Risiko nicht tolerierbarer Morbidität verbunden wäre.
Der Schnittrand-Status kann durch die Operationstechnik, Patientencharakteristika und Methoden der pathologischen Beurteilung beeinflusst werden. Diesbezüglich wurden die Inzidenz und die Lokalisation positiver Schnittränder bei 200 Roboter-assistierten laparoskopischen radikalen Prostatektomien und 200 retropubischen radikalen Prostatektomien bewertet. Bei ersterer Operationstechnik waren positive Schnittränder signifikant seltener als bei der offenen Operation (15% vs. 35%, p <0,001). Nach pathologischem Stadium stratifiziert war die Inzidenz positiver Schnittränder bei pT2-Tumoren und Roboter-assistierter gegenüber retropubischer radikaler Prostatektomie 9,4% bzw. 24,1% (p <0,001) und bei pT3-Tumoren 50% bzw. 60% [5].
Die Resultate eines systematischen Reviews und einer Metaanalyse aller erreichbarer Peer-reviewed Beobachtungsstudien zur Rate positiver Schnittränder nach offener, laparoskopischer und Roboter-assistierter Prostatektomie ergaben keine signifikanten Unterschiede bei den Operationstechniken. In der Propensity-Score-Analyse hatte die Gruppe mit laparoskopischer radikaler Prostatektomie eine höhere Rate an positiven Schnitträndern als die Roboter-assistierte Methode aber eine ähnliche Rate wie bei der offenen Chirurgie. Mit der Metaanalyse wird gezeigt, dass die Roboter-assistierte Operation der offenen und laparoskopischen Technik hinsichtlich positiver Schnittränder zumindest ebenbürtig ist [6].
In einem systematischen Review wurde die Datenlage zur Häufigkeit positiver Schnittränder bei Roboter-assistierter radikaler Prostatektomie in Fällen zusammengestellt, die als mit speziellen Schwierigkeiten behaftet eingestuft woden waren. Dabei wurden Patienten mit hohem Body Mass Index, großem Prostatavolumen, mit zuvor stattgehabter Bauchchirurgie, vorausgegangener operativer Behandlung einer benignen Prostatahyperplasie und Patienten mit Prostatamittellappen berücksichtigt. Die gepoolten Ergebnisse aus neun Studien lassen bei diesen Patienten in keinem Fall ein erhöhtes Risiko für positive Schnittränder erkennen. Bemerkenswerterweise war das Risiko für positive Schnittränder bei Patienten mit großer Prostata sogar verringert [7].
-
Bei der routinemäßigen Beurteilung der Schnittränder in den radikalen Prostatektomie-Proben sollte
laut Empfehlung der International Society of Urological Pathology (ISUP) die Lokalisation positiver
Schnittränder im Pathologiebericht genau benannt werden [8]. Dabei ist zwischen posterior, posterolateral,
lateral, anterior, apikal und proximal (Blasenhals) zu unterscheiden.
Sowohl bei Roboter-assistierten laparoskopischen radikalen Prostatektomien als auch bei retropubischen radikalen Prostatektomien war der Apex mit 52% bzw. 37% die häufigste Lokalisation positiver Schnittränder [5]. Am anterioren Rand werden positive Schnittränder hauptsächlich bei den relativ seltenen Tumoren der Übergangszone sowie selten auch den T1c-Tumoren registriert. Im Vergleich dazu ist der Apex bei Prostatakrebs im Stadium T2 sowie bei T1c-Tumoren die Prädilektionsstelle für positive Schnittränder.
 Die Beeinflussung der Lokalisation positiver Schnittränder durch das pathologische Stadium wurde
an einer Fallserie mit 180 Prostatakrebs-Patienten (pT3bN0-1) beobachtet [9].
In dieser Kohorte mit Involvierung der Samenbläschen betrug der Anteil Patienten mit positiven
Schnitträndern 41%. Sie betrafen zu 57% einen peripheren Abschnitt und zu 32% den Apex.
Die Beeinflussung der Lokalisation positiver Schnittränder durch das pathologische Stadium wurde
an einer Fallserie mit 180 Prostatakrebs-Patienten (pT3bN0-1) beobachtet [9].
In dieser Kohorte mit Involvierung der Samenbläschen betrug der Anteil Patienten mit positiven
Schnitträndern 41%. Sie betrafen zu 57% einen peripheren Abschnitt und zu 32% den Apex.
-
Die Ausdehnung positiver Schnittränder beeinflusst die Wahrscheinlichkeit des Auftretens biochemischer Rezidive.
In diesem Zusammenhang hat sich 2009 die ISUP-Konsensuskonferenz dafür ausgesprochen, die Ausdehnung positiver
Schnittränder mit der Angabe in Millimetern zu protokollieren, da subjektive Quantifizierungen wie fokal
gegenüber ausgedehnt nicht ausreichten [8].
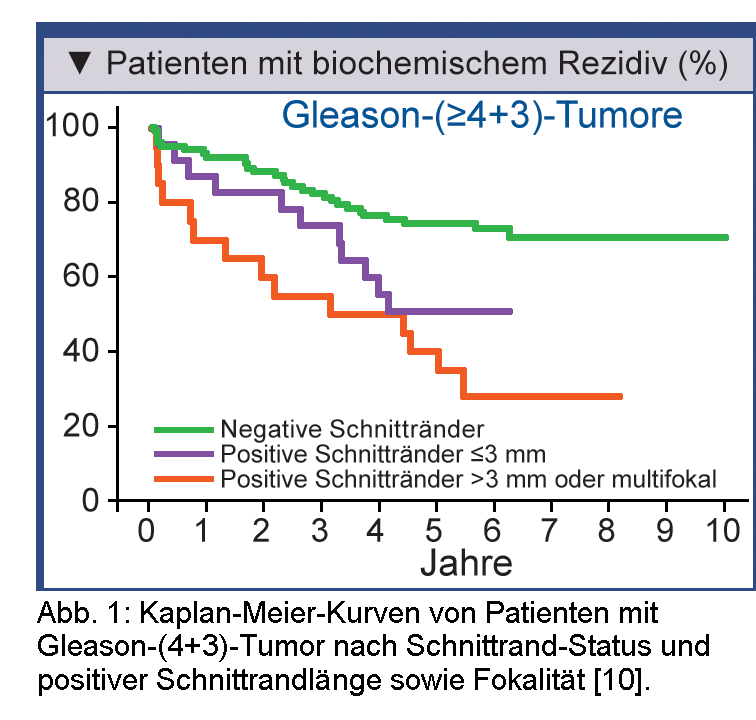
In einer Serie Roboter-assistierter radikaler Prostatektomien waren 189/893 (21%) Fälle mit positiven Schnitträndern – davon 81 >3 mm lang oder multifokal. Patienten mit positiven >3 mm/multifokalen Schnitträndern hatten hinsichtlich biochemischer Rezidive ein ungünstigeres Ergebnis als bei positiven Schnitträndern mit einer Länge 3 mm. Positive >3 mm/multifokale Schnittränder waren bei pT2- nicht aber bei pT3-Tumoren ein signifikanter Prädiktor für biochemisches Rezidiv. Kürzere positive Schnittränder hatten in beiden Stadien keinen prädiktiven Wert für biochemisches Rezidiv (Abb. 1) [10].
-
Nachdem dem Gleason-Grad am Schnittrand lange Zeit keine beachtenswerte prognostische Bedeutung beigemessen
worden war, ergab eine jüngere Analyse, dass der Gleason-Score von Tumorzellen am Schnittrand doch ein
gewichtiger prädiktiver Faktor für biochemisches Rezidiv ist (p<0,05) [11].
An der John Hopkins Klinik, Baltimore, MD, USA, dokumentieren Pathologen seit 2010 routinemäßig den Gleason-Grad an positiven Schnitträndern. Daraus standen für eine aktuelle Analyse Daten von 405 Patienten mit einem Gleason 7-Tumor und positiven Schnitträndern zur Verfügung. In 56% der Fälle war der Gleason-Grad am Schnittrand niedriger als in der definitiven pathologischen Diagnose des Primärtumors. Dabei war die Wahrscheinlichkeit eines niedrigeren Gleason-Grades am Schnittrand umso geringer, je aggressiver der Prostatakrebs war (66% bei GS 3+4, 55% bei GS 4+3, 45% bei GS 8 und 39% bei GS 9-10). Kaplan-Meier-Bestimmungen ergaben signifikant erhöhte Raten an biochemischer Rezidivfreiheit bei Patienten mit einem niedrigeren Gleason-Score am Schnittrand als in der pathologischen Enddiagnose des Primärtumors [12]. Dass der Gleason-Grad an positiven Schnitträndern nicht nur ein Prädiktor für biochemisches Rezidiv sondern auch für Prostatakrebs-spezifisches Überleben ist, wurde bei Patienten mit dem Gleason-Grad 4 am positiven Schnittrand ermittelt. Diese Patienten mit Gleason-7-Prostatakrebs hatten ein signifikant verschlechtertes 15-Jahre progressionsfreies und Prostatakrebs-spezifisches Überleben [13].
-
In der Chirurgie des Mammakarzinoms steht ein knapper Resektionsrand bei brusterhaltender Operation
mit dem Risiko für lokale Rezidive und Fernmetastasen im Zusammenhang [14].
Entsprechende Untersuchungen am resezierten Gewebe nach radikaler Prostatektomie hatten zunächst
keine vergleichbaren Ergebnisse geliefert. Auch bei sehr knappen Abständen zwischen Tumor und
 Resektionsrand von zum Teil deutlich unterhalb eines Millimeters waren keine erhöhten biochemischen
Rezidivraten berichtet worden [15-17]. Demzufolge wurde die Dokumentation des
dichtesten Abstands zwischen Tumor und Resektionsrand nicht befürwortet [16].
In jüngerer Zeit bewegt sich die Einschätzung knapper Resektionsränder aber auch beim Prostatakarzinom
in Richtung der Assoziation mit einem erhöhten Rezidivrisiko [18-20].
In einer Untersuchung mit 894 Patienten war die kumulierte rückfallfreie Überlebenszeit bei den
Patienten mit knappem Resektionsrand gegenüber jenen mit negativem Schnittrand um den Faktor zwei
verkürzt [18].
Resektionsrand von zum Teil deutlich unterhalb eines Millimeters waren keine erhöhten biochemischen
Rezidivraten berichtet worden [15-17]. Demzufolge wurde die Dokumentation des
dichtesten Abstands zwischen Tumor und Resektionsrand nicht befürwortet [16].
In jüngerer Zeit bewegt sich die Einschätzung knapper Resektionsränder aber auch beim Prostatakarzinom
in Richtung der Assoziation mit einem erhöhten Rezidivrisiko [18-20].
In einer Untersuchung mit 894 Patienten war die kumulierte rückfallfreie Überlebenszeit bei den
Patienten mit knappem Resektionsrand gegenüber jenen mit negativem Schnittrand um den Faktor zwei
verkürzt [18].In einer Kohorte mit 1.588 Prostatakrebs-Patienten, die mit radikaler Prostatektomie behandelt worden waren, hatten Männer mit sehr knappem Resektionsrand (<0,1 mm) im Vergleich zu jenen mit negativen Schnitträndern ein signifikant höheres Rezidivrisiko. Ihr Risiko unterschied sich nicht von dem bei Patienten mit positiven Schnitträndern, so dass auch mit diesen Patienten eine adjuvante Therapie besprochen werden sollte [19].
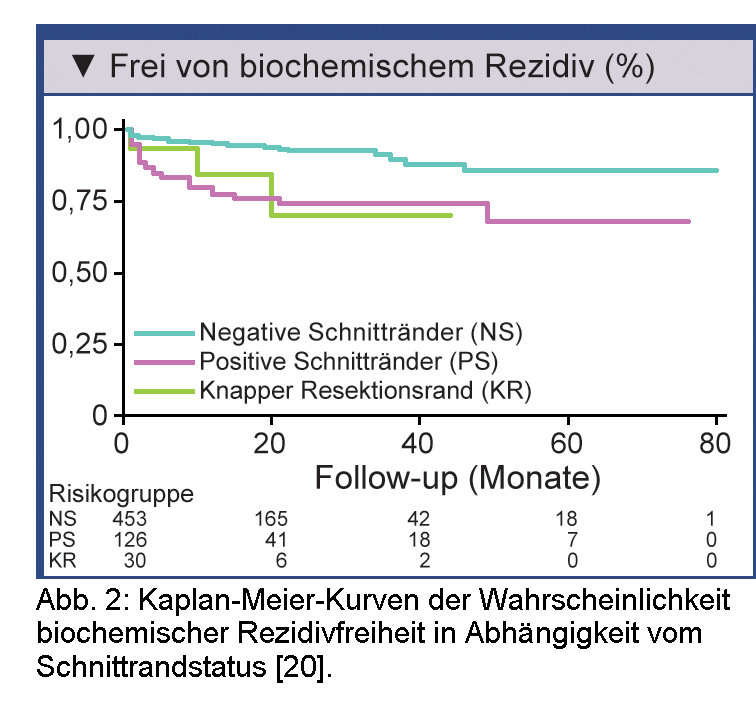
Die 3-Jahresrate an biochemischer Rezidivfreiheit war in einer Serie mit 609 radikalen Prostatektomien bei den Patienten mit knappem Resektionsrand gleich hoch wie bei den Patienten mit positiven Schnitträndern (Abb. 2) [20]. Diesbezüglich wird darauf hingewirkt, knappe Resektionsränder <1 mm ausdrücklich im Pathologiebericht zu vermerken. Betroffene Patienten sind klare Kandidaten für die adjuvante Therapie und sollten engmaschig nachverfolgt werden.
-
Der Zusammenhang zwischen positiven Schnitträndern und einem erhöhten Risiko
 für biochemisches Rezidiv wurde
in zahlreichen Untersuchungen uneingeschränkt festgestellt. Als Surrogat-Parameter für härtere Endpunkte
wie Prostatakrebs-spezifisches Überleben ist das biochemische Rezidiv allerdings nur bedingt geeignet.
Andererseits hat es den Vorteil, innerhalb eines relativ kurzen Beobachtungszeitraums von etwa fünf Jahren,
ein gefestigtes onkologisches Ergebnis zu liefern. Biochemische Rezidive treten zum Großteil bereits innerhalb
von drei Jahren nach der radikalen Pros-tatektomie und nur zu einem geringen Anteil später als nach fünf Jahren auf.
für biochemisches Rezidiv wurde
in zahlreichen Untersuchungen uneingeschränkt festgestellt. Als Surrogat-Parameter für härtere Endpunkte
wie Prostatakrebs-spezifisches Überleben ist das biochemische Rezidiv allerdings nur bedingt geeignet.
Andererseits hat es den Vorteil, innerhalb eines relativ kurzen Beobachtungszeitraums von etwa fünf Jahren,
ein gefestigtes onkologisches Ergebnis zu liefern. Biochemische Rezidive treten zum Großteil bereits innerhalb
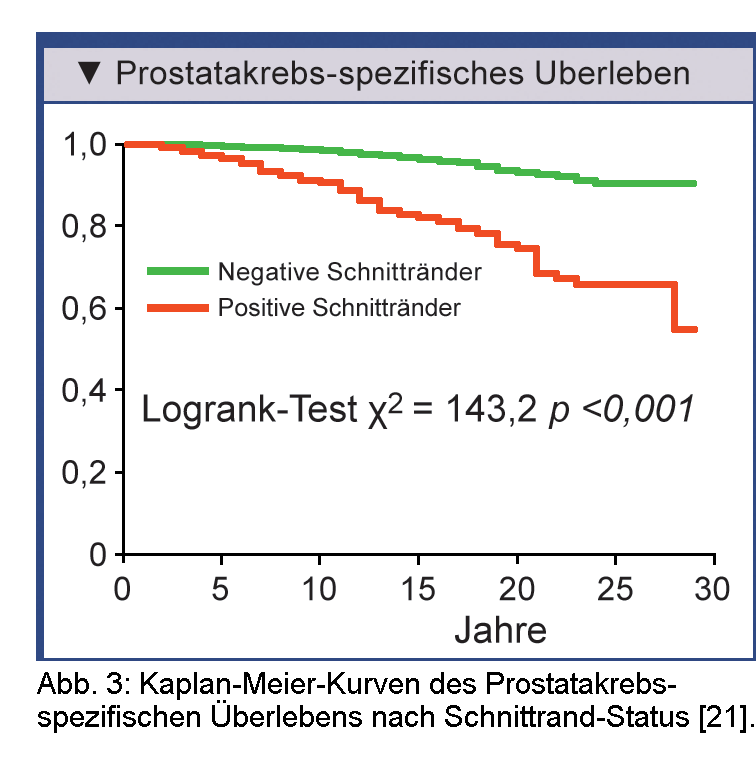
von drei Jahren nach der radikalen Pros-tatektomie und nur zu einem geringen Anteil später als nach fünf Jahren auf.Der Einfluss positiver Schnittränder auf das Prostatakrebs-spezifische Überleben wurde retrospektiv in einer Kohorte mit 4.461 Männern analysiert, die sich zwischen 1982 und 2011 bei demselben Chirurgen einer radikalen Prostatektomie unterzogen hatten [21]. Da routinemäßig keine adjuvante Therapie erfolgt war, bot sich die Möglichkeit, die langfristigen Auswirkungen positiver Schnittränder unbeeinflusst zu analysieren. In der Kaplan-Meier-Schätzung war das Prostatakrebs-spezifische Überleben bei Patienten mit positiven Schnitträndern (n=462) gegenüber dem bei denen mit negativen Schnitträndern deutlich kürzer (Abb. 3). In der multivariaten Analyse hatten positive Schnittränder zwar einen statistisch signifikanten negativen Effekt auf das Prostatakrebs-spezifische Überleben, doch der Gleason-Score und das pathologische Stadium waren aussagekräftigere Prädiktoren [21].
Der Frage, inwieweit positive Schnittränder bei der radikalen Prostatektomie eine Rolle für die
Prostatakrebs-spezifische Mortalität spielen, widmete sich insbesondere eine große amerikanische Studie
auf Bevölkerungsebene [22]. Für die Analyse wurde eine Patientenkohorte aus der
Surveillance, Epidemiology, and End Results (SEER)-Datenbank identifiziert. Sie umfasste 65.633 Prostatakrebspatienten,
die sich in den Jahren 1998 bis 2006 einer radikalen Prostatektomie unterzogen hatten und median
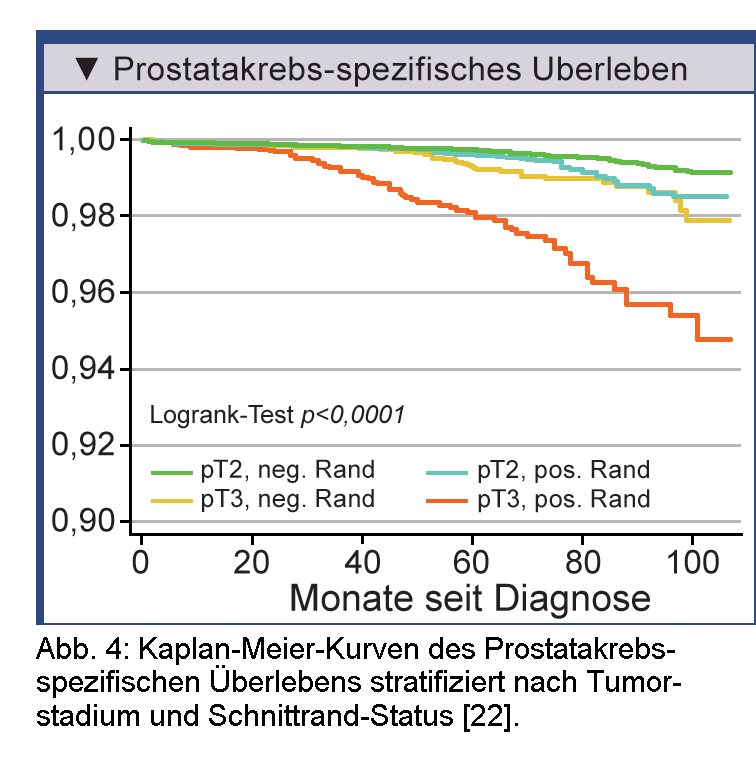 50 Monate (1 bis 107 Monate) nachverfolgt werden konnten. In 21,2% der Fälle waren positive Schnittränder
registriert worden. Insgesamt 291 (0,5%) der Männer starben an Prostatakrebs. Die kumulierte
Prostatakrebs-spezifische Mortalität war im Studienzeitraum bei den Patienten mit positiven Schnitträndern
größer als bei denen mit negativen Schnitträndern (0,86% versus 0,33%; p<0,001). Stratifiziert nach
Tumorstadium und Schnittrand-Status waren positive Schnittränder bei Patienten mit pT2-Krankheit signifikant
mit höherem Risiko für Prostatakrebs-spezifische Mortalität assoziiert (Abb. 4) [22].
50 Monate (1 bis 107 Monate) nachverfolgt werden konnten. In 21,2% der Fälle waren positive Schnittränder
registriert worden. Insgesamt 291 (0,5%) der Männer starben an Prostatakrebs. Die kumulierte
Prostatakrebs-spezifische Mortalität war im Studienzeitraum bei den Patienten mit positiven Schnitträndern
größer als bei denen mit negativen Schnitträndern (0,86% versus 0,33%; p<0,001). Stratifiziert nach
Tumorstadium und Schnittrand-Status waren positive Schnittränder bei Patienten mit pT2-Krankheit signifikant
mit höherem Risiko für Prostatakrebs-spezifische Mortalität assoziiert (Abb. 4) [22].
-
Bei positiven Schnitträndern nach radikaler Prostatektomie muss davon ausgegangen werden, dass Krebszellen
im Körper verblieben sind. Darin liegt die rationale Begründung für eine postoperative lokale Strahlentherapie.
Diese kann als adjuvante Therapie gleich nach der Operation erfolgen. Andererseits wird vielfach propagiert,
zunächst abzuwarten, bis bzw. ob es zu einem biochemischen Rezidiv kommt. Da das biochemische Rezidiv sehr
früh auf ein klinisches Rezidiv hindeutet, wird davon ausgegangen, dass das Wiederauftreten der Tumorkrankheit
mit einer Salvage-Strahlentherapie gut zu beherrschen sei.
In einer Reihe größerer Studien – European Organization for Research and Treatment of Cancer (EORTC) Study 22911 [23], Southwest Oncology Group (SWOG) Study 8794 [24], German Cancer Society (ARO 96-02) [25] – war bei Männern mit pathologisch fortgeschrittenem Prostatakrebs, die sich einer adjuvanten Strahlentherapie unterziehen, übereinstimmend eine deutliche Verringerung des biochemischen Rezidivrisikos ermittelt worden. Allein in SWOG 8794 wurde ein Zusammenhang mit Metastasenfreiheit und Überleben berichtet. Die in EORTC 22911 zunächst festgestellten Benefite hinsichtlich klinisch progressionsfreiem Überleben ließen sich bei einem Follow-up von median 10,6 Jahren nicht aufrechterhalten [26].
In einer retrospektiven Analyse des biochemisch rezidivfreien Überlebens nach adjuvanter Strahlentherapie im Vergleich zu Beobachtung und rezidivbedingter früher Salvage-Strahlentherapie bei Patienten mit pT3-, pN0-, R0–R1-Prostatakarzinom wurde geschlossen, dass sich der Krebs mit beiden Strategien vergleichbar gut kontrollieren lässt [27].
Literatur:
[1] Yossepowitch O, Bjartell A, Eastham JA, et al. 2009. Positive surgical margins in radical prostatectomy: outlining the problem and its long-term consequences. Eur Urol 55:87-99.
[2] Yossepowitch O, Briganti A, Eastham JA, et al. 2014. Positive surgical margins after radical prostatectomy: a systematic review and contemporary update. Eur Urol 65:303-313.
[3] Whalen MJ, Rothberg MB, 2016. Pathologic reporting of the surgical margin after radical prostatectomy: considerations for improving oncologic prognostication. Int J Pathol Clin Res 2:018.
[4] Huang JG, John Pedersen J, Hong MKH, et al. 2013. Presence or absence of a positive pathological margin outperforms any other margin-associated variable in predicting clinically relevant biochemical recurrence in Gleason 7 prostate cancer. BJU Int 111:921-927.
[5] Smith JA Jr1, Chan RC, Chang SS, et al. 2007. A comparison of the incidence and location of positive surgical margins in robotic assisted laparoscopic radical prostatectomy and open retropubic radical prostatectomy. J Urol 178:2385-2389.
[6] Tewari A1, Sooriakumaran P, Bloch DA, et al. 2012. Positive surgical margin and perioperative complication rates of primary surgical treatments for prostate cancer: a systematic review and meta-analysis comparing retropubic, laparoscopic, and robotic prostatectomy. Eur Urol 62:1-15.
[7] Novara G, Ficarra V, Mocellin S, et al. 2012. Systematic review and meta-analysis of studies reporting oncologic outcome after robot-assisted radical prostatectomy. Eur Urol 62 382-404.
[8] Tan PH, Cheng L, John R Srigley JR, et al. 20011. International Society of Urological Pathology (ISUP) consensus conference on handling and staging of radical prostatectomy specimens. working group 5: surgical margins. Mod Pathol 24:48–57.
[9] Pagano MJ, Whalen MJ, Paulucci DJ, et al. 2016. Predictors of biochemical recurrence in pT3b prostate cancer after radical prostatectomy without adjuvant radiotherapy. Prostate 76:226-234.
[10] Sooriakumaran P, Ploumidis A, Nyberg T, et al. 2015. The impact of length and location of positive margins in predicting biochemical recurrence after robot-assisted radical prostatectomy with a minimum follow-up of 5 years. BJU Int 115:106-113.
[11] Cao D, Kibel AS, Gao F, et al 2010. The Gleason score of tumor at the margin in radical prostatectomy is predictive of biochemical recurrence. Am J Surg Pathol 34:994-1001.
[12] Kates M, Sopko NA, Han M, et al. 2016. Importance of reporting the Gleason score at the positive surgical margin site: analysis of 4,082 consecutive radical prostatectomy cases. J Urol 195:337-342.
[13] Viers BR, Sukov WR, Gettman MT, et al. 2014. Primary Gleason grade 4 at the positive margin is associated with metastasis and death among patients with Gleason 7 prostate cancer undergoing radical prostatectomy. Eur Urol 66:1116-1124.
[14] Goldstein NS, Kestin L, Vicini F, 2003. Factors associated with ipsilateral breast failure and distant metastases in patients with invasive breast carcinoma treated with breast-conserving therapy. A clinicopathologic study of 607 neoplasms from 583 patients. Am J Clin Pathol 120:500-527.
[15] Epstein JI, Sauvageot J, 1997. Do close but negative margins in radical prostatectomy specimens increase the risk of postoperative progression? J Urol 157:241-243.
[16] Emerson RE, Koch MO, Daggy JK, Cheng L, 2005. Closest distance between tumor and resection margin in radical prostatectomy specimens: lack of prognostic significance. Am J Surg Pathol 29:225-229.
[17] Bong GW, Ritenour CW, Osunkoya AO, et al. 2009. Evaluation of modern pathological criteria for positive margins in radical prostatectomy specimens and their use for predicting biochemical recurrence. BJU Int 103:327-331.
[18] Lu J, Wirth GJ, Wu S, et al. 2012. A close surgical margin after radical prostatectomy is an independent predictor of recurrence. J Urol 188:91-97.
[19] Izard JP, True LD, May P, et al. 2014. Prostate cancer that is within 0.1 mm of the surgical margin of a radical prostatectomy predicts greater likelihood of recurrence. Am J Surg Pathol 38:333-338.
[20] Whalen MJ, Shapiro EY, Rothberg MB, et al. 2015. Close surgical margins after radical prostatectomy mimic biochemical recurrence rates of positive margins. Urol Oncol 33:494.e9-494.e14.
[21] Chalfin HJ, Dinizo M, Trock BJ, 2012. Impact of surgical margin status on prostate-cancer-specific mortality. BJU Int 110:1684-1689.
[22] Wright JL, Dalkin BL, True LD, et al. 2010. Positive surgical margins at radical prostatectomy predict prostate cancer-specific mortality: support for optimizing surgical technique and pathological evaluation at radical prostatectomy. J Urol 183:2213-2218.
[23] Bolla M, van Poppel H, Collette L, 2005. Postoperative radiotherapy after radical prostatectomy: a randomised controlled trial (EORTC trial 22911). Lancet 366:572-578.
[24] Thompson IM, Tangen CM, Paradelo J, et al. 2006. Adjuvant radiotherapy for pathologically advanced prostate cancer: a randomized clinical trial. JAMA 296:2329-35.
[25] Wiegel T, Bottke D, Steiner U, et al. 2009. Phase III postoperative adjuvant radiotherapy after radical prostatectomy compared with radical prostatectomy alone in pT3 prostate cancer with postoperative undetectable prostate-specific antigen: ARO 96-02/AUO AP 09/95. J Clin Oncol 27:2924-2930.
[26] Bolla M, van Poppel H, Tombal B, et al. 2012. Postoperative radiotherapy after radical prostatectomy for high-risk prostate cancer: long-term results of a randomised controlled trial (EORTC trial 22911). Lancet 380:2018-2027.
[27] Briganti A, Wiegel T, Joniau S, et al.2012. Early salvage radiation therapy does not compromise cancer control in patients with pT3N0 prostate cancer after radical prostatectomy: results of a match-controlled multi-institutional analysis. Eur Urol 62:472-487.
© 2003-2025 pro-anima medizin medien
–
impressum
–
mediadaten
–
konzeption
–
datenschutz
