

Immunüberwachung, Immunoediting und immuntherapeutische Ansätze
Im letzten Jahrzehnt wurden große Fortschritte hinsichtlich eines vervollkommneten Verständnisses immunologischer Prozesse im Zusammenhang mit der Entstehung und Progression von Krebserkrankungen gemacht. Daraus resultierten bereits erste zunächst in den USA zugelassene Immuntherapeutika, die bei Prostatakrebs bzw. Melanomen ihre Wirksamkeit in Phase-III-Studien unter Beweis gestellt haben. Im Krebs-Immunoediting-
Entwicklung und Progression von Prostatakrebs – wie auch anderer Krebsentitäten – beruhen wesentlich darauf,
dass sich neoplastische Zellen der Kontrolle durch das Immunsystem entziehen. In diesem Szenario spielen Entzündung
und Infektion für malignitätsauslösende Ereignisse und dynamische Prozesse, die sowohl für die Eliminierung von
Tumorzellen als auch für die Modulation des immunogenen Phänotyps von Tumoren verantwortlich sind, eine zentrale
Rolle. Dabei stehen tumorförderliche Entzündungsprozesse und protektive Tumorimmunität gemäß dem
Krebs-
Immunologische Verbindung zu Entzündungsprozessen und Infektion
-
Entzündungen der Prostata haben vielfach eine sehr komplexe Ätiologie. Abgesehen von einer Minderheit der Fälle,
in denen sich eine akute oder chronische bakterielle Infektion nachweisen lässt, wird deutlich häufiger ein
Entzündungsgeschehen ohne nachweisbare Infektion beobachtet (chronische Prostatitis/chronisches Beckenbodenschmerzsyndrom
[CP/CPPS]).
Zwischen entzündlichen Reaktionen in der Prostata und Krebsentstehung wurde anhand epidemiologischer Daten ein Zusammenhang hergestellt: Nach einer Prostatitis ist das spätere Risiko für Prostatakrebs erhöht.
Das akute Entzündungsgeschehen ruft zunächst das angeborene Immunsystem (Makrophagen, Monozyten, natürliche Killerzellen, T-Lymphozyten, neutrophile Granulozyten) auf den Plan. Häufig folgt eine erworbene (adaptive) Immunantwort zum Schutz vor Pathogenen und Krebs. Diese kann bei chronischen Entzündungen aber auch eine wesentliche Rolle bei der Tumorigenese spielen. Als Reaktion auf die entzündliche Reaktion entsteht genotoxischer Stress und trägt zur Initiation von Krebszellen bei. Ferner fördert die angeregte Zellproliferation den Krebs und durch verstärkte Angiogenese und Gewebsinvasion wird die Krankheitsprogression beschleunigt [2].
Bei und Schreiber (2007) formulierten die These, wonach das tumorförderliche Entzündungsgeschehen und die
protektive Tumorimmunität in einem dynamischen Zusammenhang stehen. Sie wetteifern um die Dominanz bei der
Entstehung von Tumorzellen und allen Stadien der Entwicklung zur klinisch manifesten Krebserkrankung [6].
Seit Kurzem ist bekannt, dass Komponenten des Immunsystems mit pro-onkotischer Aktivität in bestimmten Stadien der
Krebsentwicklung auch die Induktion von Tumorimmunität fördern können. In Tumor-
In der Prostata finden sich häufig Viren wie humane Papillomaviren (HPV), Herpes Simplex Viren und Zytomegalievirus.
Ob bzw. inwieweit Viren allerdings mit Prostatakrebs im Zusammenhang stehen, kann anhand diskrepanter Studienergebnisse
nicht abschließend beurteilt werden.
In den letzten Jahren entstand eine Debatte über einen möglichen Zusammenhang zwischen dem neu entdeckten Gammaretrovirus
xenotropic murine leukemia virus-
Hohn et al. (2009) untersuchten das Vorkommen XMRV-spezifischer Sequenzen in 589 Tumorproben von Prostatakrebs-
-
Nachdem Paul Ehrlich bereits im Jahr 1909 Vorstellungen über den Schutz des Organismus vor neoplastischen
|
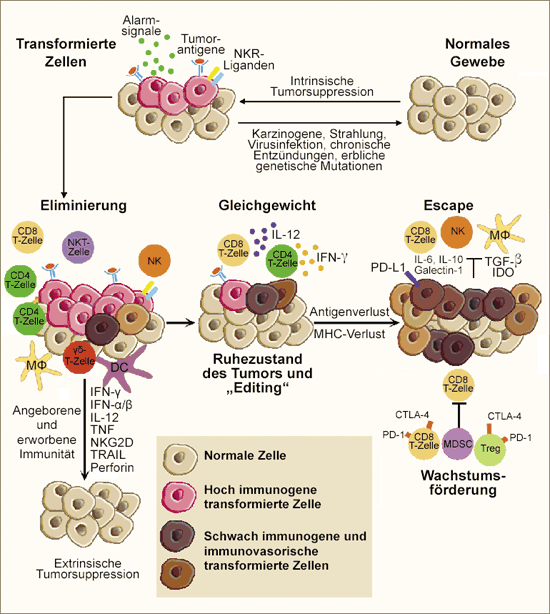
Abb. 1: Krebs-Immunoediting: Sofern intrinsische Tumorsuppressor- Eliminierungsphase: Beim frühzeitigen Angriff auf transformierte Zellen wirken das angeborene und das erworbene Immunsystem zusammen. Gleichgewichtsphase (Equilibrium): Vereinzelte Tumorzellen, die sich der eliminierung entziehen konnten, werden in der Gleichgewichtsphase vom adaptiven Immunsystem daran gehindert auszuwachsen und unterliegen zugleich der „Formung“ ihrer Immunogenizität. Aus experimentellen Versuchen mit Mäusen ist bekannt, dass T-Lymphozyten und IFN- als Effektoren an der Aufrechterhaltung des Gleichgewichts mitwirken.
Escape-Phase: Ständiger Selektionsdruck durch das Immunsystem kann zur Entstehung von Varianten führen,
die vom Immunsystem nicht mehr erkannt werden, die den Effektoren der Immunabwehr widerstehen oder ein
immunsuppressives Milieu schaffen. Zu den beteiligten Mechanismen zählen insbesondere eine fehlende oder
unzureichende Antigen-
M = Makrophage; DC = Dendritische Zelle; IDO = Indolamin-2,3-Dioxygenase;
IL = Interleukin; TNF = Tumornekrosefaktor; IFN = Interferon; NK = Natürliche Killerzelle;
NKG2D = Immunrezeptor (wirkt als aktivierender Rezeptor auf Natürlichen Killer-Zellen);
PD-L1 = programmed death 1 ligand; MDSC = Myeloid-derived suppressor cells; CTLA-4 = cytotoxic
T lymphocyte-associated antigen 4; Treg = regulatorischer T-Lymphozyt (inhibiert andere T-Zellen
zur Aufrechterhaltung immunologischer Toleranz) (adaptiert nach [1,2]).
|
In der Eliminierungsphase kommen angeborene und erworbene Immunreaktionen zur Anwendung. Als besonders schlagkräftig erweisen sich hierbei die T-Lymphozyten und die natürlichen Killerzellen. Ist deren mehrstufiger Einsatz erfolgreich, d.h. lassen sich sämtliche transformierten Zellen in statu nascendi ausmerzen, bleibt die Krankheit auf die höchstwahrscheinlich unentdeckt abgelaufene Eliminierungsphase beschränkt. Bei Prostatakrebs-
In der Gleichgewichtsphase (Equilibrium) herrscht Ausgewogenheit zwischen dem Wachstum von
Tumorzellen, die der Eliminierung entgangen sind, und der fortdauernden Zerstörung maligner Zellen durch das
Immunsystem. Diese Phase kann sich über längere Zeiträume hinziehen und gibt den Tumorzellen Gelegenheit, sich
genetisch weiter so zu verändern, dass dem Angriff des Immunsystems immer besser gewappnete Mutanten gegenüberstehen.
Andererseits wird die Gleichgewichtsphase als mögliches stabiles Endstadium des Immunoediting-
In der dritten, der Escape-Phase einer Prostatakrebs-
Nichterkennen neoplastischer Zellen
Immunsuppressiva
Zyklooxygenase-2 (COX-2) ist in der neoplastischen Prostata vielfach überexprimiert. Das aktivierte
Enzym katalysiert die von Arachidonsäure zu Prostaglandinen und anderen Eikosanoiden führende Reaktion. Eine starke
Expression von COX-2 in Prostatakarzinomen steht im Zusammenhang mit einem hohen Gleason Score und forcierter
Neovaskularisation. Die Behandlung humaner Prostatakrebs-
Deprivation von B- und T-Zell-Überlebensfaktoren
Bevor neoplastische Zellen vom Immunsystem eliminiert werden können, müssen sie sich als solche zu erkennen geben.
Hierbei spielt der Histokompatibilitätskomplex (HLA) der Klasse I eine essenzielle Rolle. Durch ihn werden den
T-Lymphozyten zelleigene Antigene (Proteinfragmente in Peptidlänge) präsentiert, die der Immunabwehr sozusagen
als Identitätsnachweis dienen. Erkennen diese die Antigene als eigen, werden sie toleriert und eine Immunreaktion
Interleukin (IL)-6 wirkt immunsuppressiv. Die Expression von IL-6 korreliert bei Prostatakrebs signifikant mit dem
klinischen Stadium. Prostatakrebs-
In der menschlichen Prostata finden sich intraepithelial und im Stroma unterschiedliche Lymphozyten-
-
Krebszellen überleben aufgrund immunologischer Toleranz. Die Patienten selbst sind nach wie vor immunkompetent.
Das eröffnet die Möglichkeit für therapeutische Strategien zur „Wiederbelebung“ anti-neoplastischer Aktivität
Sipuleucel-T besteht aus autologen dendritischen Zellen, die ex vivo mit dem Fusionsprotein (PA2024) bestehend
aus Prostata-
Vorläufige Ergebnisse mit Ipilimumab aus der Mayo-Klinik ließen bei Patienten mit fortgeschrittenem Prostatakrebs
ein drastisches Schrumpfen des Tumors erkennen. Weitere positive Vorveröffentlichungen von laufenden Studien bedürfen
allerdings noch der Bestätigung.
Ipilimumab wurde Anfang dieses Jahres von der FDA zur Second-line-
Kombinationstherapien mit zytotoxischen Substanzen und Immuntherapeutika sind ebenfalls in der Erprobung. Positive
Ergebnisse wurden Cyclophosphamid und behandelten Dendritischen Zellen bei Patienten mit kastrationsrefraktärem
Prostatakrebs berichtet [12].
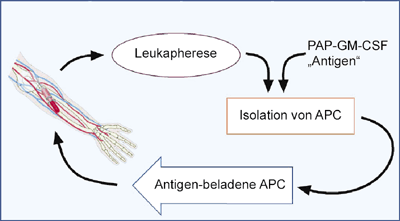
Abb. 2: Schematische Darstellung der Aufbereitung und Verabreichung des Immunotherapeutikums Sipuleucel-T: Autologe
Androgen-
Für die Zulassung von Sipuleucel-T zur Behandlung des fortgeschrittenen Prostatakarzinoms war eine Placebo-
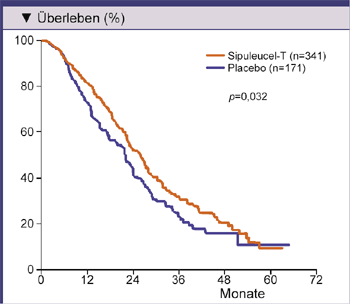
Abb. 3: Kaplan-Meier-Überlebenskurven von Patienten mit asymptomatischem oder minimal
symptomatischem metastasiertem, kastrationsresistentem Prostatakrebs bei Behandlung mit Sipuleucel-T oder
Placebo: In der Phase-III-
Ipilimumab (Vervoy) ist ein humaner Antikörper, der an CTLA-4 (cytotoxic T lymphocyte-associated antigen 4) bindet.
Diesem Antigen wird eine entscheidende Rolle bei der Regulation der Immunantwort beigemessen. Bei Fehlen von CTLA-4
wird eine gesteigerte T-Zell-Immunreaktion beobachtet. Dementsprechend wird erwartet, durch Komplexierung von CTLA-4
mit Ipilimumab einen aktiven Angriff der zytotoxischen T-Lymphozyten auf Krebszellen zu provozieren. Verschiedene
klinische Prüfungen mit Ipilimumab zur Behandlung von metastasiertem, kastrationsrefraktärem Prostatakrebs, Melanomen
und kleinzelligen Bronchialkarzinomen werden gegenwärtig durchgeführt.
Literatur:
[1] Schreiber RD, Old LJ, Smyth MJ, 2011.
Cancer Immunoediting: integrating immunity´s roles in cancer suppression and promotion. Science 331:1565-1570.
[2] Grivennikov SI, Greten R, Karin M, 2010.
Immunity, inflammation and cancer. Cell 140:883-899.
[3] Vesely MD, Kershaw MH, Schreiber RD, Smyth MJ, 2011.
Natural innate and adaptive immunity to cancer. Annu Rev Immunol 29:235-71.
[4] Rajarubendra N, Lewrentschuk N, Bolton DM, et al. 2010.
Prostate cancer – an update for Urologists. BJU Int 107:1046-1051.
[5] Dunn GP, Old LJ, Schreiber RD, 2004.
The three Es of cancer immunoediting. Annu Rev Immunol 22:329-360.
[6] Bui JD, Schreiber RD, 2007.
Cancer immunosurveillance, immunoediting and inflammation: independent or inderdependent process? Curr Opin Immunol 19:203-208.
[7] Cordero JB, Macagno JP, Stefanatos RK, et al. 2010.
Oncogenic Ras diverts a host TNF tumor suppressor activity into tumor promoter. Dev Cell 18:999-1011.
[8] Hohn O, Krause H, Barbarotto P, et al. 2009.
Lack of evidence for xenotropic murine leukemia virus-related virus (XMRV) in German prostate cancer patients. Retrovirology 6:92.
[9] Wang W, Bergh A, Damber J, 2005.
Cyclooxygenase-2 expression correlates with local chronic inflammation and tumor neovascularization in human prostate cancer. Clin Cancer Res 11:3250-3256.
[10] Di Carlo E, D´Antuono T, Pompa P, et al. 2009.
The lack of epithelial interleukin-7 and BAFF/BLyS gene expression in prostate cancer as a possible mechanism of tumor escape from immunosurveillance. Clin Cancer Res 15:2979-298.
[11] Higano C, Schellhammer PF, Small EJ, et al. 2009.
Integrated data from 2 randomized, double-blind, placebo-controlled, phase 3 trials of active cellular immunotherapy with sipuleucel-T in advanced prostate cancer. Cancer 115:3670-3679.
[12] Rozková D, Tiserová H, Fuciková, et al. 2009.
FOCUS on FOCIS: combined chemoimmunotherapy for the treatment of hormone-refractory metastatic prostate cancer. Clin Immunol 131:1-10. R.
© 2003-2025 pro-anima medizin medien
–
impressum
–
mediadaten
–
konzeption
–
datenschutz
