

Überlebensbenefit bei kastrationsresistentem Prostatakrebs?
Für Patienten mit kastrationsresistentem Prostatakrebs (CRPC) ist das therapeutische Potenzial heute
deutlich breiter gefächert als noch vor gut einem Jahrzehnt. Mit Docetaxel konnte bei CRPC erstmals
mit einer Chemotherapie gegenüber der damaligen Standardbehandlung mit Mitoxantron ein Überlebensvorteil
erreicht werden. Diese Entwicklung hat mit der Einführung von Cabazitaxel eine Fortsetzung
gefunden. Basierend auf der bahnbrechenden Erkenntnis, dass die intratumorösen Androgenspiegel
während der Progression des CRPC durch De-novo-Steroidsynthese ansteigen und Androgenrezeptoren
reaktiviert werden [1], ließen sich neue „Hormontherapien“ in die therapeutische Landschaft bei
CRPC integrieren. Zudem konnte das Gesamtüberleben bei der Behandlung von Knochenmetastasen
mit dem Alphastrahler 223 Radium verlängert werden [2]. In jüngster Zeit sind auch Immuntherapien als
vielversprechende Option bei CRPC auf den Plan getreten [Reviews 3-6]. Das scheint nur folgerichtig zu
sein, zumal Prostatakarzinome von Natur aus immunogen sind. Zunächst wurde Sipuleucel T, eine
Vakzine aus aktivierten autologen dendritischen Zellen, unter anderem auch in Deutschland zugelassen.
Aktuell befindet sich der Anti-CTLA4-
Modulierung der T-Zell-vermittelten Immunantwort durch Immun-Checkpoints
-
Zur Generierung einer effektiven Immunantwort findet in den sekundär-lymphatischen Organen die
T-Zell-
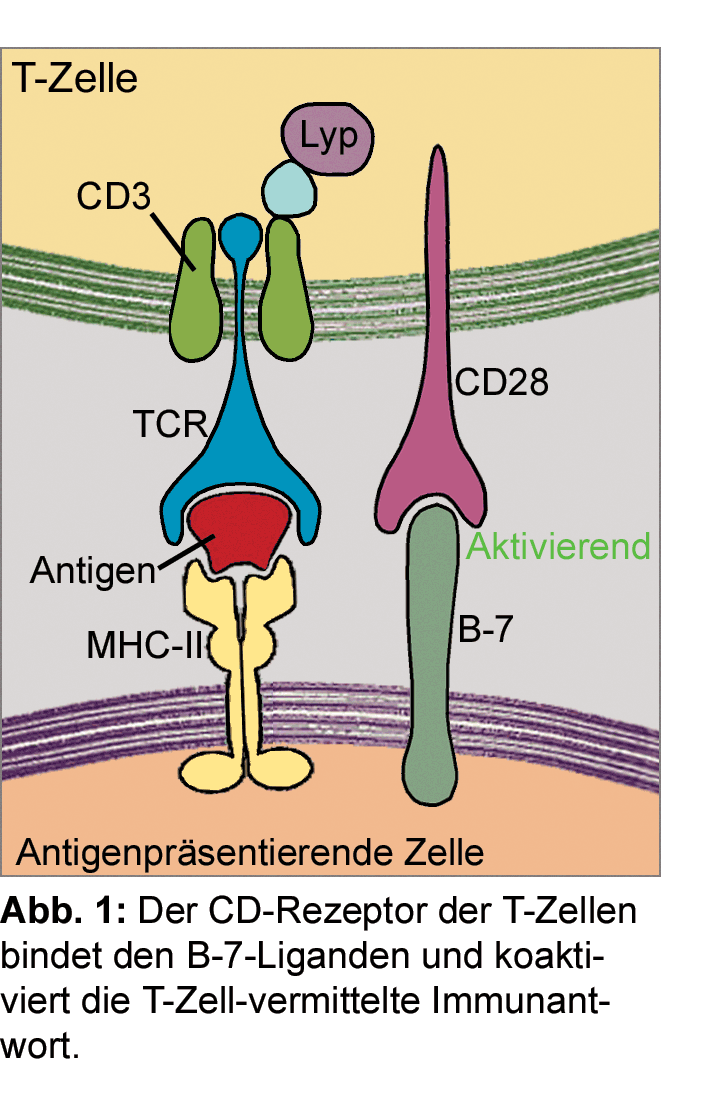
 Um eine überschießende Abwehrreaktion der T-Zellen und damit Angriffe auf körpereigene Zellen zu verhindern,
verfügt das Immunsystem über eine Fülle von Immunkontrollpunkten. Das sind negative Feedback-Mechanismen,
über die die Aktivierung der CD8+ T-Zellen gebremst wird [7]. Einer der gut untersuchten Immun-Checkpoints
ist der CTLA4-Rezeptor, der im Rahmen der Aktivierung von T-Lymphozyten durch den T-Zell-Rezeptor an der
Oberfläche der T-Zelle gesteigert exprimiert wird. Das Rezeptorprotein CTLA4 (cytotoxic T-lymphocyte-
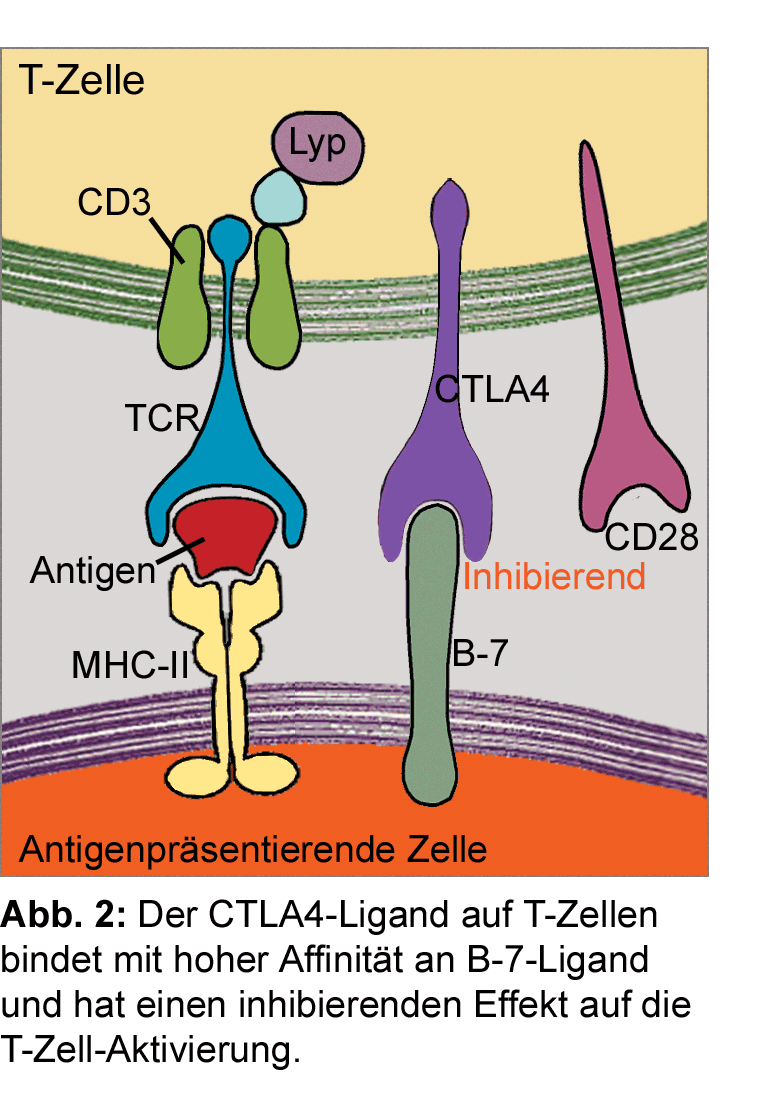
Um eine überschießende Abwehrreaktion der T-Zellen und damit Angriffe auf körpereigene Zellen zu verhindern,
verfügt das Immunsystem über eine Fülle von Immunkontrollpunkten. Das sind negative Feedback-Mechanismen,
über die die Aktivierung der CD8+ T-Zellen gebremst wird [7]. Einer der gut untersuchten Immun-Checkpoints
ist der CTLA4-Rezeptor, der im Rahmen der Aktivierung von T-Lymphozyten durch den T-Zell-Rezeptor an der
Oberfläche der T-Zelle gesteigert exprimiert wird. Das Rezeptorprotein CTLA4 (cytotoxic T-lymphocyte-
-
Haben Krebszellen durch Mutation Eigenschaften angenommen, durch die sie vom Immunsystem nicht mehr
eliminiert oder kontrolliert werden können, bieten Immun-Checkpoints mögliche Angriffspunkte für
immunonkologische Strategien. Mit Checkpoint-Inhibitoren kann die inhibitorische Starre gelöst werden,
und das Immunsystem gewinnt die Kontrolle über den Tumor zurück – so jedenfalls ist es in der Immunonkologie
mittels immun-Checkpoint-Blockade vorgesehen. In dieser Beziehung ist der Anti-CTLA4-Antikörper
Ipilimumab sehr weit fortgeschritten. Das Immuntherapeutikum ist ein rekombinanter, humanisierter
monoklonaler Antikörper und wirkt als Antagonist des CTLA4-
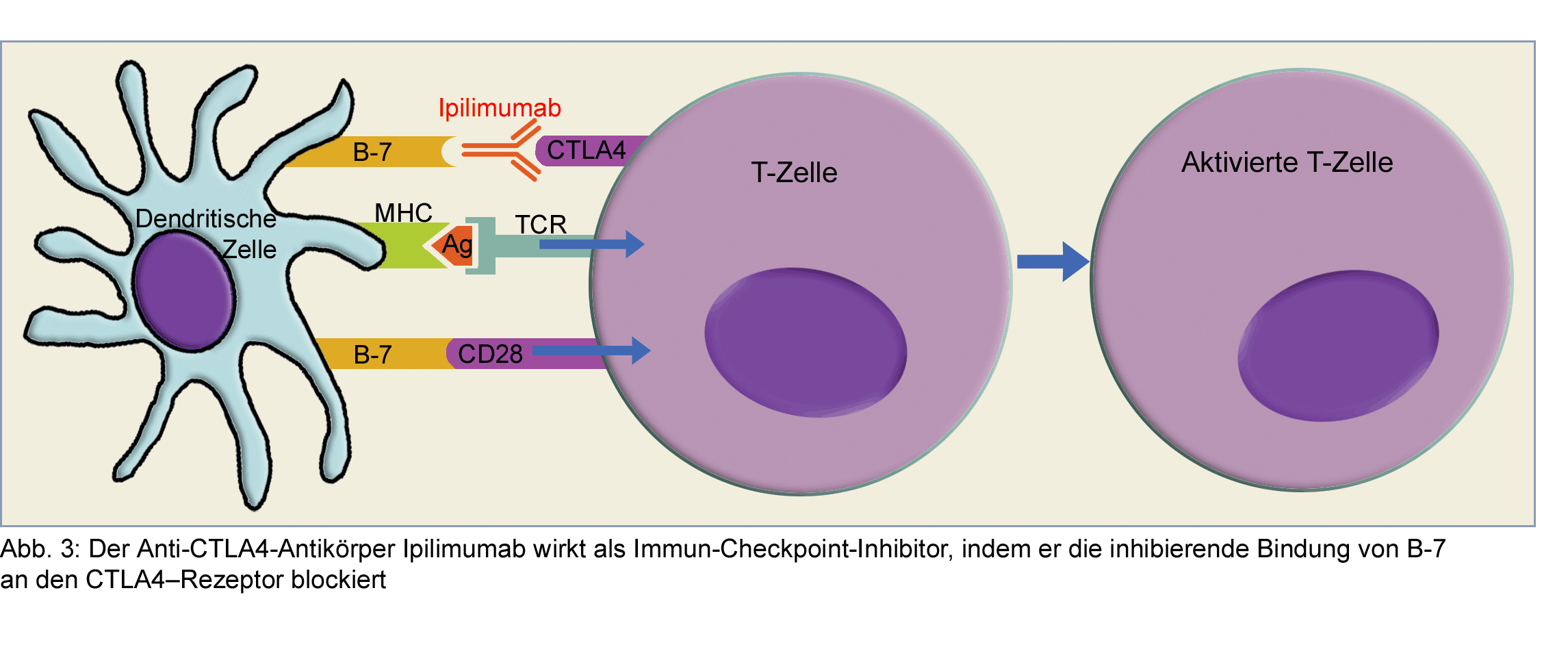 Dass Immun-Checkpoint-Blockade eine effektive Krebstherapie ist, wurde zunächst bei Patienten mit
fortgeschrittenem Melanom nachgewiesen. Bei diesen Patienten wurde mit dem Anti-CTLA4–spezifischen
monoklonalen Antikörper Ipilimumab in zwei Phase-III-Studien ein Benefit des Gesamtüberlebens (OS)
erreicht [9, 10]. Zum einen wurden Ipilimumab mit 3 mg/kg Körpergewicht in
Kombination mit der Vakzine Glykoprotein 100 (gp100), Ipilimumab-
Dass Immun-Checkpoint-Blockade eine effektive Krebstherapie ist, wurde zunächst bei Patienten mit
fortgeschrittenem Melanom nachgewiesen. Bei diesen Patienten wurde mit dem Anti-CTLA4–spezifischen
monoklonalen Antikörper Ipilimumab in zwei Phase-III-Studien ein Benefit des Gesamtüberlebens (OS)
erreicht [9, 10]. Zum einen wurden Ipilimumab mit 3 mg/kg Körpergewicht in
Kombination mit der Vakzine Glykoprotein 100 (gp100), Ipilimumab-
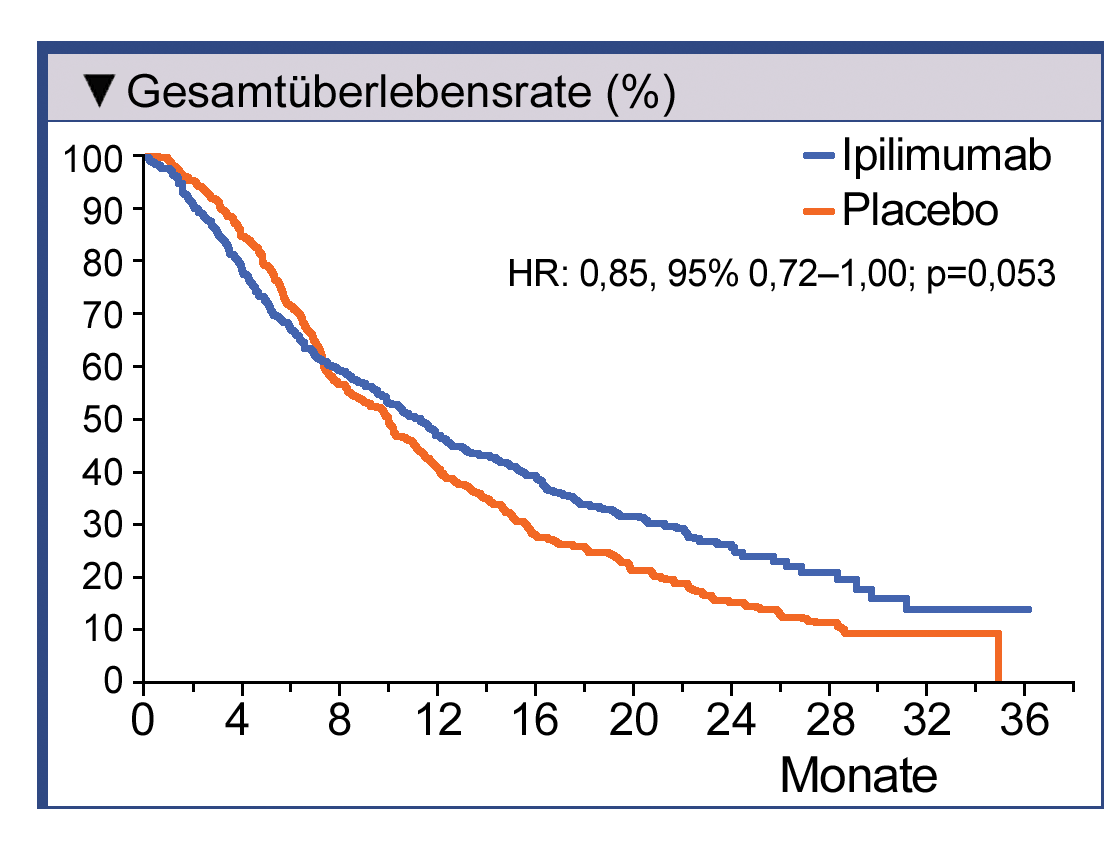
In der zweiten Phase-III-Studie wurden 10 mg/kg plus Dacarbazin bei Patienten mit zuvor unbehandeltem
metastasiertem Melanom geprüft. Bei Behandlung mit Ipilimumab in der Dosierung 10 mg/kg in Kombination
mit Dacarbazin erhöhte sich die OS-Raten der Patienten im Vergleich zur Behandlung mit Dacarbazin
signifikant – nach einem Jahr 47,3% vs. 36,3%, nach zwei Jahren 28,5% vs. 17,9% und nach drei
Jahren 20,8% vs. 12,2%. Nebenwirkungen der Grade 3 oder 4 traten bei 56,3% der mit Ipilimumab plus
Dacarbazin behandelten Patienten auf. Bei Dacarbazin plus Placebo waren es vergleichsweise nur 27,5%.
In der Ipilimumab/Dacarbazin-
Die Ansprechraten waren in den Prüfungen allerdings relativ niedrig. Andererseits wurde bei einem Großteil
der Responder ein anhaltendes Ansprechen oder stabile Krankheit über etliche Jahre hinweg erreicht. Das
führte durch die US Food and Drug Administration im Jahr 2011 zur Zulassung von Ipilimumab für Patienten
mit nicht resezierbarem oder metastasiertem Melanom in der Dosierung von 3 mg/kg. Die positive Bewertung
wird durch eine große gepoolte Analyse des OS mit 1.861 Patienten mit fortgeschrittenem Melanom aus zehn
prospektiven und zwei retrospektiven Phase-II- und -III-Studien sowie einer zweiten Analyse mit OS-Daten
(n=4.846) von zusätzlichen 2.985 Patenten aus einem Expanded-
-
Noch vor seiner erfolgreichen Anwendung bei Melanomen war Ipilimumab in einer Studie am Menschen bei
Patienten mit kastrationsresistentem Prostatakrebs (CRPC) geprüft worden. Zur Ermittlung der Pharmakokinetik
und dem Sicherheitsprofil waren in einer Pilotstudie 14 Patienten mit einer Einzeldosis Ipilimumab (3 mg/kg)
behandelt worden [12]. Von den Männern mit metastasiertem CRPC wurde die Behandlung allgemein gut vertragen.
Häufig berichtete Nebenwirkungen – überwiegend Grad 1 – waren Arthralgien, Unwohlsein, Knochenschmerzen,
Rückenschmerzen, Konstipation, Fatigue und Appetitlosigkeit. Schwerwiegende Ereignisse, die der Therapie
zuzuordnen waren, beschränkten sich auf zwei Patienten – einer mit Grad 3 Fatigue und einer mit Grad 3 Exanthem
und Pruritus. Zwei Patienten erfuhren einen PSA-Abfall 50%, der 135 bzw. 60 Tage anhielt. Beide Patienten
wünschten mit Ipilimumab weiterbehandelt zu werden. Allerdings trat nach der zweiten Dosis Ipilimumab kein
PSA-Abfall 50% ein.
Unter den Folgestudien ist insbesondere eine Untersuchung hervorzuheben, in der Patienten mit metastasiertem
CRPC Ipilimumab als Monotherapie oder in Kombination mit Strahlentherapie erhielten [13].
Die Rationale basierte auf präklinischen Indizien für synergistische Tumoraktivität zwischen
Anti-CTLA4-
Die bis dahin als zukunftsträchtig eingeschätzten Ergebnisse führten dazu, dass zwei
Phase-III-
In der gegenwärtig noch laufenden Phase-III-Studie CA184-095 wird die obige Hypothese überprüft,
wonach Ipilimumab bei Vorliegen günstiger Prognosemerkmale besonders aktiv ist. Die rekrutierten
Patienten mit metastasiertem, Chemotherapie-naivem CRPC sind asymptomatisch oder minimal
symptomatisch und haben keine viszeralen Metastasen. Als primärer Studienendpunkt ist OS
vorgesehen [15].
 war Komplettansprechen eingetreten (Dauer: 11,3+ Monate) und in sechs Fällen lag stabile Krankheit vor
(Dauer: 2,8 bis 6,1 Monate). Bei den insgesamt 50 Patienten, in denen mit 10 mg/kg Ipilimumab behandelt
worden war, betrafen die meisten der mit der Immuntherapie im Zusammenhang stehenden Nebenwirkungen die
Haut, das Magen-Darm-System und die Leber. Das Sicherheitsprofil bei der verwendeten Höchstdosis von
10 mg/kg wurde im Großen und Ganzen als beherrschbar eingestuft. Mehrheitlich handelte es sich um
Grad-1-Ereignisse.
war Komplettansprechen eingetreten (Dauer: 11,3+ Monate) und in sechs Fällen lag stabile Krankheit vor
(Dauer: 2,8 bis 6,1 Monate). Bei den insgesamt 50 Patienten, in denen mit 10 mg/kg Ipilimumab behandelt
worden war, betrafen die meisten der mit der Immuntherapie im Zusammenhang stehenden Nebenwirkungen die
Haut, das Magen-Darm-System und die Leber. Das Sicherheitsprofil bei der verwendeten Höchstdosis von
10 mg/kg wurde im Großen und Ganzen als beherrschbar eingestuft. Mehrheitlich handelte es sich um
Grad-1-Ereignisse.
[1] Locke JA, Guns ES, Lubik AA, et al. 2008. Androgen Levels increase by intratumoral de novo steroidogenesis during progression of castration-
[2] Parker C, Nilsson S, Heinrich D, et al. 2013. Alpha emitter radium-223 and survival in metastatic prostate cancer. N Engl J Med 369:213-223.
[3] Saad F, Miller K, 2015. Current and Emerging Immunotherapies for Castration-resistant Prostate Cancer. Urology 85:976-986.
[4] Tse BW-C, Jovanovic L, Nelson CC, et al. 2014. From bench to bedside: immunotherapy for prostate cancer. Biomed Res Int doi: 10.1155/2014/981434
[5] Cha E, Small EJ, 2013. Is there a role for immune checkpoint blockade with ipilimumab in prostate cancer? Cancer Med 2:243-252.
[6] Boikos SA, Antonarakis ES, 2012. Immunotherapy for prostate cancer enters Its golden age. Clin Med Insights Oncol 6:263-273.
[7] Petrausch U, Pestalozzi BC, 2014. Der Krebs auf dem Bremspedal des Immunsystems. Schweiz Med Forum 2014;14:32-34.
[8] Phan TG, Long GV, Scolyer RA, 2015. Checkpoint inhibitors for cancer immunotherapy. Multiple checkpoints on the long road towards cancer immunotherapy. Immunol Cell Biol 93:323-325.
[9] Hodi FS, O’DaySJ, McDermott DF, et al. 2010. Improved survival with ipilimumab in patients with metastatic melanoma. N Engl J Med 363:711-723.
[10] Robert C, Thomas L, Bondarenko I, et al. 2011. Ipilimumab plus dacarbazine for previously untrea ted metastatic melanoma. N Engl J Med 364:2517-2526.
[11] Schadendorf D, Hodi FS, Robert C, et al. 2015. Pooled analysis of long-term survival data from phase II and phase III trials of ipilimumab in unresectable or metastatic melanoma. J Clin Oncol 33:1889-1894.
[12] Eric J. Small E, Tchekmedyian NS, Rini BI, et al. 2007. A pilot trial of CTLA-4 blockade with human anti-CTLA-4 in patients with hormone-refractory prostate cancer. Clin Cancer Res 13:1810-1815.
[13] Slovin SF, Higano CS, Hamid O, et al. 2013. Ipilimumab alone or in combination with radiotherapy inmetastatic castration-resistant prostate cancer: resultsfrom an open-label, multicenter phase I/II study. Ann Oncol 24:1813-1821.
[14] Kwon ED, Drake CG, Scher HI, et al. 2014. Ipilimumab versus placebo after radiotherapy in patients with metastatic castration-resistant prostate cancer that had progressed after docetaxel che motherapy (CA184-043): a multicentre, rando mised, double-blind, phase 3 trial. Lancet Oncol 15:700-712.
[15] Beer TM, Logothetis C, Sharma P, et al. CA184-095. 2013. A randomized, double-blind, phase 3 trial to compare the efficacy of ipilimumab vs placebo in asymptomatic or minimally symptomatic patients with metastatic chemotherapy-naïve castration-resistant prostate cancer. Presented at: annual meeting of the American Society of Clinical Oncology; May 31-June 4, 2013; Chicago, IL. Poster TPS5093.
© 2003-2025 pro-anima medizin medien
–
impressum
–
mediadaten
–
konzeption
–
datenschutz

 jfs
jfs