

Das Prostatakarzinom ist zurzeit das Malignom bei Männern der westlichen Welt mit der höchsten Inzidenz und der zweithöchsten tumorbedingten Mortalität [1]. So hat inzwischen auch in Deutschland seit 1998 das Prostatakarzinom die höchste Inzidenz aller malignen Erkrankungen des Mannes. Die jüngsten epidemiologischen Daten zeigen, dass u.a. durch den vermehrten Einsatz des prostataspezifischen Antigens (PSA) bei der Früherkennung und beim Screening zunehmend jüngere Patienten mit gut differenzierten und lokalisierten Tumoren des niedrigen und intermediären Risikotyps detektiert werden. Gerade für diese zunehmend größer werdende Gruppe von erkrankten Männern steht mit der interstitiellen Brachytherapie ein Verfahren zur Verfügung, das eine effiziente Tumorkontrolle bei geringer therapiebedingter Morbidität bietet.
Der erste Bericht über den Einsatz der Brachytherapie an der Prostata stammt aus dem Jahr 1911 von Pasteau [2]. Erstmalig wurde diese innovative Therapieform im Jahr 1913 anlässlich des International Medical Congress in London von der wissenschaftlichen Welt wahrgenommen. Pasteau und Degrais stellten dort ihre Technik vor, bei der über einen Silbertubus, der in die Harnröhre eingeführt wurde, eine Radiumquelle, die an einem Draht befestigt war an die Prostata herangeführt wurde und dort für eine definierte Zeitspanne zur Bestrahlung verblieb [3]. Nahezu zeitgleich stellte Paschkis die erste zystoskopisch kontrollierte Radium-Applikation vor [4]. Seit diesen frühen Tagen hat sich die interstitielle Brachytherapie insbesondere durch technische Entwicklungen wie den transrektalen Ultraschall und den Einsatz von intraoperativen auch dreidimensionalen Planungsmethoden zu einer etablierten Therapieform des lokalisierten Prostatakarzinoms entwickelt.
-
Neben der radikalen operativen Behandlung gewinnen strahlentherapeutische Ansätze zur Behandlung des
lokalisierten Prostatakarzinoms zunehmend an Bedeutung. Während die Strahlentherapie in zurückliegenden
Jahren meist zur Therapie lokal fortgeschrittener Prostatakarzinome und zur Palliation metastasenbedingter
Komplikationen eingesetzt wurde, hat die Einführung bzw. technische Modifikation neuer Verfahren der
Strahlenapplikation zu einem vermehrten Einsatz dieser Therapie auch bei örtlich begrenzten
Prostatakarzinomen geführt. So haben die externe 3D-Konformationsbehandlung und die
transrektal-
-
Grundsätzlich existieren zwei methodisch unterschiedliche brachytherapeutische Verfahren. Auf der
einen Seite die „Low-dose rate (LDR)“ Brachytherapie unter der Verwendung von Jod-125 (J-125),
Palladium-103 (Pd-103), Gold-198 (Au-198), Ytterbium-169 (Yb-169) oder Caesium 131 (Cs-131) Seeds,
auf der anderen Seite die „High-dose rate (HDR)“ Brachytherapie oder Afterloadingimplantation mit
Iridium-192 (Ir-192) mit einem schrittweise bewegten Strahler, der wieder entfernt wird. Beide
Verfahren ermöglichen die Applikation einer hohen Zieldosis unter Verwendung einer Strahlenqualität
mit nur geringer Tiefenwirkung und damit minimierter Strahlenbelastung des periprostatischen Gewebes
wie z.B. Rektum, Urethra oder Harnblase. Während der Einsatz der HDR-Brachytherapie als Monotherapie
ohne ergänzende perkutane Aufsättigung auf Grund fehlender langfristiger Therapieergebnisse noch als
experimentell anzusehen ist, liegen für den Einsatz der LDR-Brachytherapie als Monotherapie beim
lokalisierten Prostatakarzinom ausreichende Erfahrungen vor, um diese Therapieform als kurativen
Behandlungsansatz als etabliert zu betrachten.
Es existieren grundsätzlich zwei verschiedene Formen für die permanente interstitielle Brachytherapie. Die erste wurde zu Beginn der 80er Jahre in Seattle entwickelt und basierte auf der Erstellung eines Bestrahlungsplans vor der Therapie. Serielle Ultraschallbilder in 5 mm Schichtdicke wurden zu einem vor der Therapie gelegenen Zeitpunkt erstellt und zur Erstellung eines Bestrahlungsplanes im Vorfeld der Implantation verwendet. Dieser Plan wurde dann zu einem späteren Zeitpunkt im Operationssaal umgesetzt. Die Seeds wurden entweder in vorgeladenen Nadeln unter Verwendung von Platzhaltern oder fixiert in Strängen aus absorbierbarem Material verwendet [6-8].
Alternativ wurde im Mount Sinai Zentrum in New York in den späten 80er und frühen 90er Jahren die
„Real-time-
Bisher fehlen prospektiv randomisierte Studien, die die Überlegenheit der einen oder anderen Methode
belegen würden, aber die Amerikanische Gesellschaft für Brachytherapie (ABS) hat die intraoperative
Planungsmethode als die zu bevorzugende Technik der Brachytherapie propagiert [12].
Auch die Planungssoftware ist in den letzten Jahren kontinuierlich weiterentwickelt worden. Während
die ersten transperinealen Implantationen in Seattle noch mit relativ groben Planungsschemata vorgenommen
wurden und die Seeds uniform nach der Quimby-
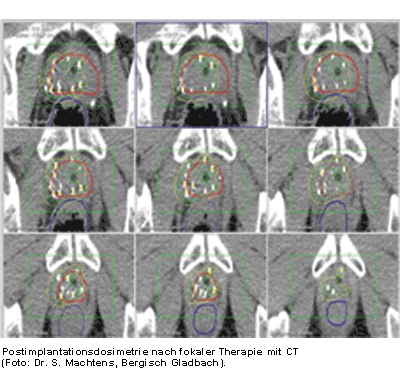
Eine möglichst hohe Übereinstimmung zwischen intraoperativer und postoperativer Dosisverteilung
gilt als Qualitätsmerkmal der Implantation. Die CT-gestützte Dosiskontrolle sollte 4 bis 6 Wochen
nach der Implantation durchgeführt werden, um das Abklingen des implantationsbedingten Ödems der
Prostata abzuwarten. Die Ergebnisse der Postimplantationsdosimetrie lassen Vorhersagen bezüglich
der Tumorkontrolle und der therapiebedingten Morbidität zu. So konnten überlegene rezidivfreie
Überlebenszeiten für die Patienten dokumentiert werden, die in der Postimplantationsdosimetrie
mehr als 140Gy in über 90% des Prostata (D90) aufwiesen [14].
Die applizierte rektale und urethrale Dosis korrelierte mit der Inzidenz proktitischer bzw.
urethritischer Nebenwirkungen [15, 16].
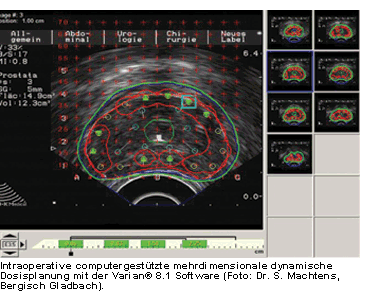
 Die Einführung der Postimplantationsdosimetrie durch Computertomographie (CT) mit Hilfe einer
3-D-Software macht eine relativ genaue Dosiskontrolle im Anschluss an eine rein ultraschallgestützte
Implantation möglich.
Die Einführung der Postimplantationsdosimetrie durch Computertomographie (CT) mit Hilfe einer
3-D-Software macht eine relativ genaue Dosiskontrolle im Anschluss an eine rein ultraschallgestützte
Implantation möglich.
-
Die alleinige permanente Brachytherapie mit Implantation von Radioisotopen kann auf Grund der
physikalischen Eigenschaften der eingesetzten Strahler nur bei lokal begrenzten Prostatakarzinomen
kurativ eingesetzt werden.
 Aus diesem Grund wird in der aktuellen deutschen S3-Leitlinie zur Diagnostik und Therapie des
Prostatakarzinoms die interstitielle LDR-Monotherapie als primäre Therapieoption nur für Patienten
mit lokal begrenztem Prostatakarzinom mit niedrigem Risikoprofil empfohlen. Für Patienten mit lokal
begrenztem Prostatakarzinom des mittleren Risikoprofils wird eine Empfehlung aufgrund der heterogenen
Datenlage weiterhin nicht gegeben. Für Patienten mit lokalisierten Prostatakarzinomen des hohen
Risikoprofils wird der Einsatz der LDR-Brachytherapie in Kombination mit perkutaner Bestrahlung
und/oder hormonablativer Therapie nur unter der Bedingung eines kontrollierten Studiendesigns
empfohlen [17].
Aus diesem Grund wird in der aktuellen deutschen S3-Leitlinie zur Diagnostik und Therapie des
Prostatakarzinoms die interstitielle LDR-Monotherapie als primäre Therapieoption nur für Patienten
mit lokal begrenztem Prostatakarzinom mit niedrigem Risikoprofil empfohlen. Für Patienten mit lokal
begrenztem Prostatakarzinom des mittleren Risikoprofils wird eine Empfehlung aufgrund der heterogenen
Datenlage weiterhin nicht gegeben. Für Patienten mit lokalisierten Prostatakarzinomen des hohen
Risikoprofils wird der Einsatz der LDR-Brachytherapie in Kombination mit perkutaner Bestrahlung
und/oder hormonablativer Therapie nur unter der Bedingung eines kontrollierten Studiendesigns
empfohlen [17].
Die Indikation zum alleinigen Einsatz der Seed-Therapie wird definiert für Patienten mit einem klinischen Stadium T2a, einer Gleason-Summe <7 und einem PSA-Wert bei Diagnosestellung <10 ng/ml. Weiterhin sollte das Volumen der Prostata <60 ml und der Schambeinwinkel weit genug für eine perineale Implantation sein. Zur Vermeidung von gravierenden Miktionssymptomen wie Harnverhalt, Strang- oder Dysurie oder Harninkontinenz werden ein prätherapeutischer Internationaler Prostata Symptom Score (IPSS) 12, möglichst keine Restharnbildung sowie Zustände nach TUR-P mit nur kleinem intraprostatischem Defekt gefordert [17].
In den Empfehlungen der europäischen Gesellschaften für Strahlentherapie (ESTRO), Urologie (EAU)
zusammen mit der EORTC werden folgende Kontraindikationen für die permanente Seed-Implantation gesehen:
1. Eine Lebenserwartung des Patienten <5 Jahren.
2. Der Nachweis von Metastasen.
3. Eine kürzlich durchgeführte TURP mit persistierendem großem zentralem Defekt.
4. Patienten mit Störungen der physiologischen Gerinnung.
5. Eine Größe der Prostata >50 ccm wegen möglicher Interferenz mit dem Schambeinwinkel.
Auch in diesen Empfehlungen wird eine Gruppe von Patienten definiert, die insbesondere vom
alleinigen Einsatz der permanenten interstitiellen Brachytherapie profitiert. Das klinische
Stadium bei Diagnosestellung sollte T2a, der S-PSA Wert <10ng/ml und die Gleason Summe der
Biopsie 6 sein [18]. In den aktuellen Leitlinien der American Brachytherapy Society (ABS) wird
die alleinige LDR-Brachytherapie für den niedrigen Risikobereich favorisiert. Die alleinige oder
mit perkutaner Bestrahlung und Hormondeprivation kombinierte LDR-Brachytherapie wird im intermediären
Risikobereich als optional gesehen. Im hohen Risikobereich wird die Kombination aus LDR Brachytherapie,
perkutaner Strahlentherapie und Hormondeprivation empfohlen [19].
-
Die Beurteilung des Therapieerfolgs nach interstitieller Brachytherapie erfolgte in den vergangenen
Jahren meistens durch die Beschreibung eines stabilen, nicht-ansteigenden PSA-Wertes und nicht durch
die Angabe des PSA-Nadirs. Dabei kamen die Kriterien der „American Society for Therapeutic Radiology
and Oncology (ASTRO)“ zur Anwendung, in denen ein serologisches Rezidiv erst durch den dreimaligen
konsekutiven Nachweis eines steigenden PSA-Wertes bei einem zeitlichen Mindestabstand von drei Monaten
zwischen den Laborkontrollen definiert ist [20]. Ein PSA-Nadir von <0,2 ng/ml wurde als alternatives
Erfolgskriterium vorgeschlagen [21, 22].
 Eine Langzeituntersuchung mit einem Follow-up von sieben Jahren hat allerdings gezeigt, dass die
Vorhersage des Therapieerfolgs sowohl anhand der ASTRO-Kriterien als auch durch die Beschreibung des
PSA-Nadirs gleich zuverlässig möglich ist [23]. Aktuell wird ein Therapieversagen
mit dem Zeitpunkt definiert, an dem der PSA-Wert den Nadir um 2 ng/ml überschreitet. Der Abfall des
PSA Wertes kann sich über eine Zeitspanne von 4Jahren erstrecken [24]. In diesem
Zeitraum erleben etwa 35% der Patienten einen temporären PSA-Anstieg von >0,2 ng/ml, einen sog.
„PSA-bounce“ [25].
Eine Langzeituntersuchung mit einem Follow-up von sieben Jahren hat allerdings gezeigt, dass die
Vorhersage des Therapieerfolgs sowohl anhand der ASTRO-Kriterien als auch durch die Beschreibung des
PSA-Nadirs gleich zuverlässig möglich ist [23]. Aktuell wird ein Therapieversagen
mit dem Zeitpunkt definiert, an dem der PSA-Wert den Nadir um 2 ng/ml überschreitet. Der Abfall des
PSA Wertes kann sich über eine Zeitspanne von 4Jahren erstrecken [24]. In diesem
Zeitraum erleben etwa 35% der Patienten einen temporären PSA-Anstieg von >0,2 ng/ml, einen sog.
„PSA-bounce“ [25].
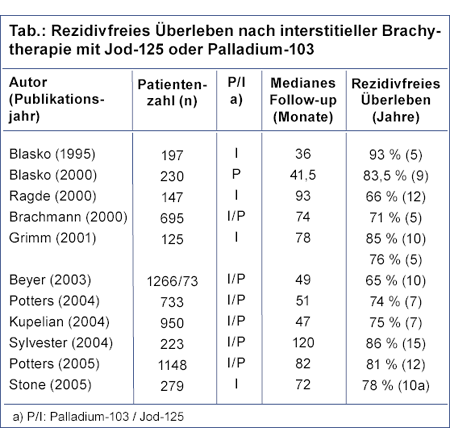
Patienten mit niedrigem Risiko für ein lokal fortgeschrittenes Tumorwachstum oder eine Metastasierung (PSA <10 ng/ml, Gleason-Summe <7, klinisches Stadium T2a) zeigen die besten Ergebnisse nach interstitieller Brachytherapie als Monotherapie. Der Anteil der Patienten ohne serologisches Rezidiv (PSA-Rezidivfrei), die ein Follow-up von mindestens fünf Jahren aufwiesen, lag zwischen 65-93%. In zwei Serien mit einer Nachbeobachtungszeit von zehn Jahren lag die biochemisch rezidivfreie Überlebensrate zwischen 66-85% (Tab.).
Für Patienten der mittleren Risikogruppe (Gleason 7 oder PSA 10 ng/ml oder klinisches Stadium T2b), die mit einer interstitiellen Brachytherapie als Monotherapie behandelt wurden, lagen die 5-Jahres biochemisch rezidivfreien Überlebensraten zwischen 32-82%. Diese teilweise sehr geringen Tumorkontrollraten haben heute dazu geführt, dass die interstitielle Brachytherapie in dieser Risikoklasse zunehmend in Kombination mit anderen Therapieformen (Externe Bestrahlung, Hormonablation) eingesetzt wird. Gleiches gilt für die Patienten der Hochrisiko-Gruppe, bei denen die Tumorkontrollraten nach Monotherapie mit Seeds noch geringer sind.
Da ähnlich wie für andere Therapieformen des lokalisierten Prostatakarzinoms keine prospektiv randomisierten Ergebnisse zur Tumorkontrolle vorliegen wurden kürzlich im Rahmen einer Metaanalyse die biochemisch progressionsfreien Verläufe der LDR-Brachytherapie mit anderen therapeutischen Ansätzen in den verschiedenen Risikoklassen verglichen. Dabei zeigte sich die LDR-Brachytherapie in allen Risikostrukturen im Vergleich zu anderen Therapieformen als mindestens gleich effektiv [26].
Weitere Daten zur Effektivität und Nebenwirkungen der LDR-Brachytherapie sind im Rahmen angelaufener umfangreicher Versorgungsstudien wie z.B. der ProBrachy® Datenbasis zu erwarten, die inzwischen mehr als 3.500 Patienten aus 32 Zentren rekrutierte, nachbeobachten.
Erkenntnisgewinn bezüglich eines prospektiv randomisierten Therapiergebnisvergleiches wird aktuell von
der PREFERE Studie erwartet, in der auch Patienten des niedrig-intermediären Risikos präferenzbasiert
inkludiert sind.
-
Die durch interstitielle Brachytherapie induzierte Morbidität kann akut (innerhalb des ersten Jahres
nach der Implantation) oder chronisch auftreten (nach dem ersten Jahr nach der Implantation).
Die Morbidität kann den Harntrakt, das Rektum oder die sexuelle Funktion betreffen.
-
Die akute Morbidität nach Seed-Implantation ist durch die Bestrahlung und durch das Nadeltrauma bedingt.
Die Nadelinsertion kann zur Ausbildung von perinealen Hämatomen oder Schwellungen, Hämaturie und im schwersten
Fall zur Blasentamponade führen. Ein Harnverhalt nach Implantation wurde bei 5-22% der Patienten nach
Monotherapie und zwischen 5-14,5% nach Kombinationstherapie beobachtet [27, 28].
Die Wahrscheinlichkeit für eine komplette Harnretention korrelierte mit der Größe der Prostata, dem prätherapeutischen Internationalen Prostata Symptom Score (IPSS) [29]. Diese Nebenwirkung manifestierte sich typischerweise in den ersten sechs Tagen nach dem Eingriff. Der überwiegende Teil der behandelten Patienten zeigt akute Miktionsbeschwerden in Form von Dysurie, Pollakisurie, Drangsymptomen, abgeschwächten Harnstrahl oder Nykturie. Typischerweise bilden sich diese Beschwerden bei 90% der therapierten Männer innerhalb des ersten Jahres komplett zurück.
Die Notwendigkeit zur transurethralen Resektion (TUR-P) bei protrahierten obstruktiven Miktionsbeschwerden
wird zwischen 0-8,7% angegeben [30, 31]. Die Inzidenz einer Harninkontinenz liegt nach
Implantation zwischen 0-19% und steigt in Kombination mit einer TUR-P bis auf 22% an [32, 33].
Die akute rektale Morbidität ist gekennzeichnet durch Tenesmen und Defäkationsreiz in Kombination mit der Miktion,
und limitiert sich bei fast allen Patienten in den ersten drei Monaten nach der Implantation [34].
-
Chronische Miktionsbeschwerden können sowohl in Form irritativer oder obstruktiver Symptome, als auch von
Inkontinenz auftreten. Grad III Miktionsstörungen nach Klassifikation der RTOG wurden in 1-3% der therapierten
Patienten berichtet und sind häufig auf Überdosierung der Bestrahlung an der Harnblasenbasis oder anhaltende
radiogen induzierte Entzündungen der prostatischen Harnröhre zurückzuführen [35, 36].
 Operative Interventionen an der Prostata vor der Implantation und Seedplatzierungen um die bulbäre Urethra
prädisponieren zur Ausbildung von Blasenhalsstrikturen und werden bei bis zu 12% der Patienten im Langzeitverlauf
beschrieben [37].
Operative Interventionen an der Prostata vor der Implantation und Seedplatzierungen um die bulbäre Urethra
prädisponieren zur Ausbildung von Blasenhalsstrikturen und werden bei bis zu 12% der Patienten im Langzeitverlauf
beschrieben [37].
Chronische rektale Komplikationen können aus einer permanenten Seed-Implantation resultieren. Der Schweregrad
dieser Veränderungen variiert zwischen gelegentlichen transanalen Blutungen bis zur Entstehung von
rekto-
Eine intestinale Symptomatik (z.B. erhöhte Stuhlfrequenz, rektale Blutung) tritt nach retrospektiven Analyse
im Rahmen der S3-Leitlinienerstellung nach perkutaner Bestrahlung oder Brachytherapie häufiger auf als nach
radikaler Prostatektomie, aber es ergaben sich Hinweise für einen Vorteil der LDR-Brachytherapie gegenüber
der perkutanen Strahlentherapie bezüglich der Enddarmfunktion [17].
Der Erhalt der erektilen Funktion ist für viele Männer der Grund, sich durch interstitielle Bachytherapie
therapieren zu lassen. Die Wahrscheinlichkeit, in einem Zeitraum zwischen 1-6 Jahren nach der Implantation
noch eine für den Geschlechtsverkehr ausreichende erektile Funktion zu haben, liegt zwischen 53-86%
Die Kombination der interstitiellen Brachytherapie mit der externen Bestrahlung und/oder der Hormondeprivation
reduziert die Wahrscheinlichkeit eines Erektionserhalts signifikant. So konnten Potters et al. nach fünf
Jahren einen Erektionserhalt bei 76% der Patienten nachweisen, die die permanente Brachytherapie als
Monotherapie erhalten hatten. Diese Rate reduzierte sich auf 56%, wenn eine Kombination aus interstitieller
Brachytherapie und externer Strahlentherapie eingesetzt wurde und auf 29% im Fall einer Kombination aus
interstitieller und externer Strahlentherapie mit einer neoadjuvanten Hormonablation [46].
Die Ansprechrate auf eine orale erektionsinduzierende Medikation ist nach interstitieller Brachytherapie
signifikant höher als nach dem Einsatz anderer Therapieformen [47].
 [42, 43]. In vergleichenden Kohortenstudien ist die Häufigkeit von Sexualstörungen nach
LDR-Brachytherapie niedriger als nach radikaler Prostatektomie oder perkutaner Strahlentherapie
[17]. Der Erektionserhalt ist signifikant mit dem präinterventionellen Erektionsstatus
korreliert. Während 70% der Männer, die vor der Implantation einen uneingeschränkten Erektionsstatus
aufwiesen, diesen auch sechs Jahre nach der Seed-Therapie zeigten, lag diese Rate bei Patienten mit
eingeschränkter Erektionsfunktion vor der Brachytherapie bei 34% [44]. Es werden
zunehmend Daten publiziert, die eine Abhängigkeit der Erektionsfunktion von der Strahlendosis, die auf
den Bulbus penis appliziert wird, zeigen. Eine Limitierung der auf die Crura penis applizierten
Strahlendosis ist zur Protektion der Erektion anzustreben [45].
[42, 43]. In vergleichenden Kohortenstudien ist die Häufigkeit von Sexualstörungen nach
LDR-Brachytherapie niedriger als nach radikaler Prostatektomie oder perkutaner Strahlentherapie
[17]. Der Erektionserhalt ist signifikant mit dem präinterventionellen Erektionsstatus
korreliert. Während 70% der Männer, die vor der Implantation einen uneingeschränkten Erektionsstatus
aufwiesen, diesen auch sechs Jahre nach der Seed-Therapie zeigten, lag diese Rate bei Patienten mit
eingeschränkter Erektionsfunktion vor der Brachytherapie bei 34% [44]. Es werden
zunehmend Daten publiziert, die eine Abhängigkeit der Erektionsfunktion von der Strahlendosis, die auf
den Bulbus penis appliziert wird, zeigen. Eine Limitierung der auf die Crura penis applizierten
Strahlendosis ist zur Protektion der Erektion anzustreben [45].
[1] Ferlay J, et al. 2006. Estimates of the cancer incidence and mortality in Europe 2006. Ann Oncol 18:581-592.
[2] Pasteau O. Traitment du cancer de la prostate par la radium. Review Malades Nutrition 1911:363.
[3] International Congress of Medicine, London, 1913, Section XIV, Urology, Part II, 28-29.
[4] Paschkis. 1911. Wiener klinische Wochenschrift 24:1562-1564.
[5] Tseng et al. 2013. J Clin Oncol 31, suppl. abstract 5024.
[6] Ragde H, Blasko JC, Grimm PD, et al. 1997. Interstitial iodine-125 radiation without adjuvant therapy in the treatment of clinically localized prostate carcinoma. Cancer 80:442-453.
[7] Blasko JC, Ragde H, Schumacher D. 1987. Transperineal percutaneous iodine-125 implantation for prostatic carcinoma using transrectal ultrasound and template guidance. Endocure Hyperthermia Oncology 3:131-139.
[8] Kaye KW, Olson DJ, Payne JT. 1995. Detailed preliminary analysis of 125Iodine implantation for localized prostate cancer using percutaneous approach. J Urol 153:1020-1025.
[9] Stone NN, Ramin SA, Wesson MF, et al. 1995. Laparoscopic pelvic lymph node dissection combined with real-time interactive transrectal ultrasound guided transperineal radioactive seed implantation of the prostate. J Urol 153:1555-1560.
[10] Stone NN, Stock RG, DeWyngaert JK, et al. 1995. Prostate brachytherapy: improvements in prostate volume measurements and dose distribution using interactive ultrasound guided implantation and three-dimensional dosimetry. Radiat Oncol Investig 3:185-195.
[11] Stock RG, Stone NN, Wesson MF, et al. 1995. A modified technique allowing interactive ultrasound-guided three-dimensional transperineal prostate implantation. Int J Radiat Oncol Biol Phys 32:219-225.
[12] Nag S, Ciezki JP, Cormack R, et al. 2001. Intraoperative planning and evaluation of permanent prostate brachytherapy: report of the American Brachytherapy Society. Int J Radiat Oncol Biol Phys 51:1422-1430.
[13] Quimby EH. 1932. The grouping of radium tubes in packs and plaques to produce the desired distribution of radiation. AJR 27:18-36.
[14] Stock RG, Stone NN, Tabert A, Iannuzzi C, DeWyngaert JK. 1998. A dose-response study for I-125 prostate implants. Int J Radiat Oncol Biol Phys 41:101-108.
[15] Desai J, Stock RG, Stone NN, Iannuzzi C, DeWyngaert JK. 1998. Acute urinary morbidity following I-125 interstitial implantation of the prostate gland. Radiat Oncol Investig 6:135-141.
[16] Snyder KM, Stock RG, Hong SM, Lo YC, Stone NN. 2001. Defining the risk of developing grade 2 proctitis following 125-J prostate brachy-therapy using a rectal dose-volume histogram analysis. Int J Radiat Oncol Biol Phys 50:335-341.
[17] http://www.awmf.org/leitlinien/aktuelle-leitlinien.html
[18] Ash D, Flynn A, Battermann J, et al. 2000. ESTRO/EAU/EORTC recommendations on permanent seed implantation for localized prostate cancer. Radiotherapy and Oncology 57:315-321.
[19] Davis BJ et al. 2012. American Brachytherapy Society consensus guidelines for transrectal ultrasound-guided permanent prostate brachy-therapy. Brachytherapy 11:6-19.
[20] Consensus statement. Guidelines for PSA following radiation therapy. Int J Radiat Oncol Biol Phys 37:1035-1041, 1997.
[21] Critz FA, Levinson AK, Williams WH: 1997. The PSA nadir that indicates potential cure after radiotherapy for prostate cancer. Urology 49:322-326.
[22] Critz FA, Tarlton RS, Holladay DA. 1995. Prostate specific antigen-monitored combination radiotherapy for patients with prostate cancer: I-125 implant followed by external-beam radiation. Cancer 75:2383-2391.
[23] Grimm PD, Blasko JC, Sylvester JE. 2001. 10 year biochemical (prostate specific antigen) control of prostate cancer with I-125 brachytherapy. Int J Rad Oncol Biol Phys 49:31-40.
[24] Iannuzzi CM, Stock RG, Stone NN. 1999. PSA kinetics following I-125 radioactive seed implantation in the treatment of T1-T2 prostate cancer. Radiat Oncol Invest 7:30-35.
[25] Cavagnagh W, Blasko JC, Grimm PD. 2000. Transient elevation of serum prostate specific antigen following I-125/Pd-103 brachytherapy for localized prostate cancer. Sem Urol Oncol 18(2):160-165.
[26] Grimm P, et al. 2012. Comparative analysis of prostate-specific antigen free survival outcomes for patients with low, intermediate and high risk prostate cancer treatment by radical therapy. Results from the Prostate Cancer Results Studa Group. BJU Int 109 (Suppl.1), 22-29.
[27] Benoit RM, Naslund M, Cohen JL. 2000. Complications after prostate brachytherapy in the medicare population. Urology 55:91-96.
[28] Terk MD, Stock RG, Stone NN. 1998. Identification of patients at increased risk for prolonged urinary retention following radioactive seed implantation of the prostate. J Urol 160:1379.
[29] Gelbblum DY, Potters L, Ashley R, et al. 1999. Urinary morbidity following ultrasound-guided transperineal prostate seed implantation. Int J Radiat Oncol Biol Phys 45: 59-65.
[30] Storey MR, Landgren RC, Cottone R. 1999. Transperineal iodine-125 implantation for treatment of clinically localized prostate cancer: 5-year tumor control and morbidity. Int J Radiat Oncol Biol Phys 43:565-571.
[31] Wallner K, Roy J, Harrison L. 1996. Tumor control and morbidity following transperineal iodine-125 implantation for stage T1/T2 prostatic carcinoma. J Clin Oncol 14:449-453.
[32] Kaye KW, Olson DJ, Payne JT. 1995. Detailed preliminary analysis of 125 iodine implantation for localized prostate cancer using percutaneous approach. J Urol 153:1020-1025.
[33] Wallner K, Lee H, Wassermann S, Dattoli M. 1997. Low risk of urinary incontinence following prostate brachytherapy in patients with prior transurethral resection. Int J Radiat Oncol Biol Phys 37:565-569.
[34] Stone NN, Stock RG. 2002. Complications following permanent prostate brachytherapy. European Urology 41:427-433.
[35] Zelefsky MJ, Wallner KE, Ling CC, et al. 1999. Comparison of 5-year outcome and morbidity of three-dimensional conformal radiotherapy versus transperineal permanent iodine-125 implantation for early-stage prostatic cancer. J Clin Oncol 17:517-523.
[36] Brown D, Colonias A, Miller R, et. al. 2000. Urinary morbidity with a modified peripheral loading technique of transperineal 125 J implantation. Int J Radiat Oncol Biol Phys 47:353-361.
[37] Ragde H, Blasko JC, Grimm PD, Kenny GM, Sylvester JE. 1997. Interstitial iodine-125 radiation without adjuvant therapy in the treatment of clinically localized prostate carcinoma. Cancer 80:442-448.
[38] Beyer DC, PriestlyJB Jr. 1997. Biochemical disease-free survival following I-125 prostate implantation. Int J Radiat Oncol Biol Phys 37:559-563.
[39] Zeitlin SI, Sherman J, Raboy A, Lederman G, Albert P. 1998. High dose combination radiotherapy for the treatment of localized prostate cancer. J Urol 160:91-95.
[40] Theodorescu D, Gillenwater JY, Schneider BF, Koutrouvelis PG. 2000. Prostatourethral-rectal fistula following prostate brachytherapy: incidence and risk factors. J Urol 163:1294 (abstract).
[41] Gelbblum DY, Potters L. 2000. Rectal complications associated with transperineal interstitial brachytherapy for prostate cancer. Int J Radiat Oncol Biol Phys 48:119-124.
[42] Merrick GS, Butler WM, Galbreath RW, et al. 2002. Erectile function after permanent prostate brachytherapy. Int J Radiat Oncol Biol Phys 52:893-902.
[43] Stock RG, Kao J, Stone NN. 2001. Penile erectile function after permanent radioactive seed implantation for treatment of prostate cancer. J Urol 165:436-439.
[44] Kao J, Stock RG, Stone NN. 2000. Long-term erectile function following real-time ultrasound-guided brachytherapy for prostate cancer. J Urol 163:1276 (abstract).
[45] Merrick GS, Butler WM, Wallner KE. 2002. The importance of radiation doses to the penile bulb vs. crura in the development of postbrachytherapy erectile dysfunction. Int J Radiation Oncology Biol Phys 54:1055-1062.
[46] Potters L, Torre T, Fearn PA, Leibel SA, Kattan MW. 2001. Potency after permanent prostate brachytherapy for localized prostate cancer. Int J Radiat Oncol Biol Phys 50:1235-1242.
[47] Merrick GS, Butler WM, Lief JH, et al. 1999. Efficacy of sildenafil citrate in prostate brachytherapy patients with erectile dysfunction. Urology 53:1112-1116.
[48] Langley S, et al. 2012. report of consensus meeting on focal low dose rate Brachytherapy for prostate cancer. BJU Int 109 (Suppl.1), 7-16,20.
© 2003-2025 pro-anima medizin medien
–
impressum
–
mediadaten
–
konzeption
–
datenschutz

 Dr. med. Stefan Machtens (Begergisch Gladbach)
Dr. med. Stefan Machtens (Begergisch Gladbach)