
Zielgerichtete Behandlungsstrategie mittels synthetisch letaler Interaktion
Synthetische Letalität stellt einen effektiven, nebenwirkungsarmen und innovativen Therapieansatz dar, da sie unter Berücksichtigung molekularer Veränderungen in Tumorzellen die selektive Behandlung dieser Zellen ermöglicht.
Mit der Poly-ADP–Ribose-Polymerase (PARP)-Inhibition wird in letzter Zeit auch bei Prostatakarzinom (PCa)-Patienten eine Strategie der medikamentösen Behandlung angewendet, in der molekulare Eigenschaften des Tumors zu einer synthetisch letalen Interaktion führen. Diese Interaktion beruht auf Gendefekten, von denen der medikamentös herbeigeführte Effekt dann zur Letalität anwächst, wenn bereits ein Gen mutiert ist, durch das sich der induzierte Defekt ausbügeln ließe. Die PARP-Inhibition stellt für eine Subgruppe von Patienten eine effektive, nebenwirkungsarme Therapieoption dar.
Rolle der PARP bei der DNA-Schadensantwort
Proteine der Enzymfamilie der PARP sind über die posttranslationelle Modifizierung, die Poly(ADP-ribosyl)ierung, in verschiedene zelluläre
Prozesse wie die DNA-Schadensantwort (DDR; DNA damage response) eingebunden (Kraus, 2015). Insbesondere die Isoform PARP1 aber auch
PARP2 haben aufgrund ihrer Mitwirkung an der DNA-Einzelstrangreparatur (Basen- und Nukleotid-Exzisionsreparatur) Funktionen, die für die
Lebebenfähigkeit von Zellen entscheidend sind. Daneben wurden auch Beteiligungen der PARP in alternativen DNA-Reparaturwegen wie dem
nicht-homologen End-Joining (NHEJ), homologer Rekombination und DNA-Mismatch-Reparatur beschrieben (Patel et al., 2011; Rose et al., 2020).
PARP-1 ist am Schutz der Replikationsgabel beteiligt. Diesbezüglich wurde bereits früh hypothetisiert, dass eine Blockade dieses Schutzes letztendlich zum Zelltod führt (Farmer et al., 2005; Bryant et al., 2009).
PARP-1 als entscheidender Effektor der
Androgenrezeptor-Transkription
Neben den Funktionen bei der DNA-Schadensantwort wirkt PARP-1 auch als ein Regulator von Transkriptionsfaktoren. Bei Prostatakrebs ist
sowohl die DNA-Reparatur als auch die transkriptionelle Aktivität der Androgenrezeptoren (AR) von PARP-1 abhängig. In Androgenrezeptor (AR)-positiven
Prostatakrebszellen ruft PARP-1 ungeachtet des Vorliegens genotoxischer Insulte pro-tumorigene Effekte hervor. Das steht im Zusammenhang damit,
dass PARP-1 die AR-Transkription fördert. Damit empfiehlt sich beim Prostatakarzinom die zielgerichtete Therapie gegen PARP-1 zur Supprimierung
des Tumorwachstums und der Progression zur Kastrationsresistenz (Schiewer, et al., 2012).
Durch PARP-2 wird die AR-vermittelte Transkription durch Interaktion mit dem als Pionierfaktor agierenden FOXA (Forkhead box protein A1) erhöht. Zielgerichtete Therapien gegen PARP-2 werden als möglicher alternativer Ansatz zur AR-Inhibition ohne Involvierung der AR-Ligandenbindung angesehen (Gui et al., 2019).
Prinzipien der PARP-Inhibition
Bereits bei den Untersuchungen zu PARP-Funktionen war ins Auge gefasst worden, dass der Faktor als Angriffsziel geeignet erscheint. Das führte
zur Entwicklung gleich mehrerer PARP-Inhibitoren: Olaparib, Niraparib, Rucaparib, Talazoparib und Veliparib.
Insofern PARP-Funktionen sowohl für die transkriptionelle Aktivität des Androgenrezeptors als auch bei der DNA-Reparatur erforderlich sind, ist die Behandlung von Prostatakrebs mit einem PARP-Inhibitor eine zweigleisige Therapie mit Angriffspunkten in der AR-Transkription und der DNA-Schadensantwort. Letzterer Faktor war in der Krebstherapie zunächst das vorrangige Ziel. So wurde in erster Linie das Unterbinden der DNA-Einzelstrangreparatur ins Auge gefasst. Nach dem Prinzip der synthetischen Letalität ist die Behandlung mit einem PARP-Inhibitor bei Patienten mit defekter homologer Rekombination wie bei Tumoren mit einer BRCA-Mutation angebracht (Abb. 1). Andererseits soll dabei die Reparatur von Chemotherapie-verursachten Schäden an der DNA verhindert werden (Chen, 2011).
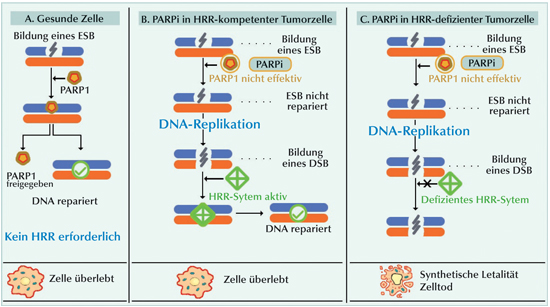
|
Abb. 1: Prinzip der synthetischen Letalität, und wie sie bei Verwendung von PARP-Inhibitoren (PARPi) in Zellen mit defizienter homologer Rekombinationsreparatur erreicht wird. (A) Unter Standardbedingungen, PARP-Proteine reparieren Einzelstrangbrüche (ESB). (B) In homologe Rekombinationsreparatur (HRR)-kompetenten Zellen verhindert die Anwendung von PARPi, dass ESB repariert werden. Durch die Replikation wird der ESB in einen Doppelstrangbruch (DSB) umgewandelt. Unter Anwendung von HRR überleben die Zellen. (C) In HRR-defizienten Zellen können mit PARPi weder ESB noch DSB repariert werden. Das führt durch Synergie zwischen PARPi und defizienter HRR zum Zelltod; ein Synergismus, der als synthetische Letalität bezeichnet wird (nach Teyssonneau et al., 2021). |
Vorkommen von DNA-Reparaturgen-Mutationen bei Prostatakrebs
Im Zusammenhang mit dem Eingang von PARP-Inhibitoren in die Behandlung von Prostatakrebs ist das Vorkommen an Mutationen in einem
DDR-Gen in den unterschiedlichen Tumorstadien von Interesse. In genomischen Analysen des metastasierten Prostatakarzinoms wurde eine
Reihe rekurrenter genomischer Alterationen identifiziert. Darunter sind Genveränderungen mit klinisch ausnutzbarem Potenzial, wie
Funktionsverlustmutationen in DNA-Reparaturgenen wie Genen der homologen Rekombinationsreparatur (Armenia, et al. 2018).
In einer Population von 692 Männern mit metastasiertem Prostatakrebs fanden Pritchard et al. (2016) insgesamt 86 DNA-Reparaturgen-Mutationen in der Keimlinie (11,8%). Das ist substanziell mehr als die zuvor berichtete Häufigkeit von ~1,20% ausschließlich BRCA2-Mutationen in der Keimbahn von Prostatakrebspatienten im Alter von 65 Jahren (Kote-Jarai et al., 2011). Bei Fällen von Prostatakrebs unter Ashkenazi-Juden waren 2,4% Träger von BRCA2-Mutationen (Gallagher et al., 2010). In 191 Proben von familiärem Prostatakrebs entdeckten Leongamornlert et al. (2014) 14 putative Funktionsverlustmutationen (7,3%).
In fortgeschrittenem Prostatakrebs liegen Aberrationen von BRCA2, BRCA1 und ATM substanziell häufiger vor (19,3% insgesamt) als in primärem Prostatakrebs (Dan et al., 2015). Dabei wurde berechnet, dass ungefähr 12% der mCRPC-Patienten Träger von DDR-Mutationen in der Keimbahn sind, und dass in 20–25% der Fälle somatische DDR-Mutationen vorliegen. Es wird davon ausgegangen, dass bei insgesamt fast 22,7% der mCRPC-Patienten Mutationen in DDR-verwandten Genen nachgewiesen werden könnten (Dan et al., 2015).
Initiale Phase der PARP-Inhibition beim PCa
In der vorklinischen Ära der PARP-Inhibitoren waren kultivierte Prostatakrebszellen mit BRCA1- oder BRCA2-Mutation erste Studienobjekte,
die als homologe Rekombination (HR)-defiziente Phänotypen mit PARP-Inhibitoren inkubiert wurden (Taylor et al., 2023). Dabei zeigte sich,
dass BRCA2-defiziente Zellen, aufgrund des Ausfalls der homologen Rekombination, gegenüber PARP-Inhibitoren höchst sensitiv sind
(Bryant et al., 2005; Farmer et al., 2005).
Die Wirksamkeit der PARP-Inhibition wurde auch in Zellen mit anderen genetischen Defekten, die die homologe Rekombination beeinträchtigen, nachgewiesen. Dazu zählt ein mutiertes Ataxia telangiectasia (ATM)-Gen (Weston et al., 2010) und eine Überexprimierung von Aurora Kinase A, die für den Zusammenbau einer funktionsgemäßen Mitosespindel benötigt wird (Sourisseau et al., 2010). Auch eine infolge PTEN-Defizienz unzulängliche homologe Rekombination sensitiviert Tumorzellen gegenüber PARP-Inhibitoren (Mendes-Pereira et al., 2009).
Die Phase der klinischen Prüfung mit PARP-Inhibitoren begann mit dem zunächst beschriebenen Olaparib. Mit ihm wurden erste Behandlungen auf Phase-I-Ebene zur Dosisfindung bei soliden Tumoren mit BRCA1- oder BRCA2-Mutation durchgeführt. Dabei zeigte sich Antitumoraktivität und Olaparib verursachte wenige der unerwünschten Effekte einer konventionellen Chemotherapie (Fong et al., 2009). Bei mCRPC-Patienten mit einer Defizienz in der homologen Rekombinationsreparatur konnte mit Olaparib erstmals eine Verbesserung des Gesamtüberlebens nachgewiesen werden (Teyssonneau, et al. 2021).
Olaparib ist ein oral bioverfügbarer Inhibitor der katalytischen PARP1- und PARP2-Aktivität, die Schlüsselfunktionen bei der DNA-Schadensantwort innehaben. In der Phase-I-Situation beim mCRPC mit Defekten in DNA-Reparaturgenen wurde eine hohe Ansprechrate erreicht. Auch in zwei Prüfungen der Phase II mit vergleichbaren mCRPC-Patienten bestätigte sich die Antitumoraktivität. Sie bilden eine Basis, auf der nachfolgende randomisierte Studien der Phase III durchgeführt wurden oder momentan laufen (Mateo et al., (2015; 2020).
Studienlage der PARP-Inhibition beim kastrationsresistenten PCa
PROfound: In der für die Zulassung von Olaparib maßgeblichen multizentrischen Open-label-Studie waren 256 Patienten mit Olaparib
und 131 Patienten (Kontrollen) mit Enzalutamid oder Abirateronacetat behandelt worden (de Bono et al., 2020). Dabei wurde der PARP-Inhibitor
bei mCRPC-Patienten bewertet, die während der Behandlung mit einer neuen Hormontherapie progredient geworden sind. Als Eignung für die
Studie wiesen die Männer in der Kohorte A (n=245) zumindest eine Alteration im BRCA1-, BRCA2- oder ATM-Gen auf. Eine Kohorte B umfasste
Männer (n=142), bei denen Alterationen in einem von 12 weiteren vorgegebenen Genen vorlagen. Primärer Endpunkt war das PFS in Kohorte A,
das von einem unabhängigen verblindeten Review anhand der Bildgebung bewertet wurde.
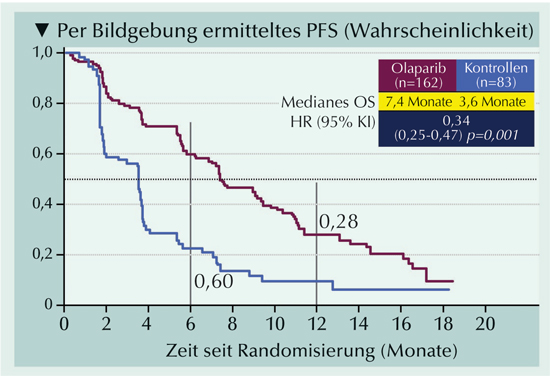
|
Abb. 2: Vom verblindeten unabhängigen zentralen Review anhand der Bildgebung bewertetes PFS bei Patienten mit zumindest einer Mutation im BRCA1-, BRCA2- oder ATM-Gen (Kohorte A), die entweder Olaparib oder nach Ermessen des Arztes Enzalutamid oder Abirateron (Kontrollen) erhalten hatten (nach de Bono et al., 2020). |
Bei den Männern in Kohorte A führte die Behandlung mit Olaparib zu signifikant längerem PFS als die Gabe einer nach Ermessen des Prüfarztes gewählten neuen Hormontherapie (Abb. 2). Auch in der Gesamtpopulation mit einer Alteration aus allen 15 Genen mit einer direkten oder indirekten Rolle bei der homologen Rekombinationsreparatur wurde ein Benefitvorteil mit Olaparib festgestellt (de Bono et al., 2020).
Die Ergebnisse der finalen OS-Analyse wurden noch im selben Jahr berichtet (Hussain et al., 2020): In Kohorte A wurde eine mediane OS-Dauer von 19,1 Monaten mit Olaparib versus 14,7 Monaten mit der Kontrollbehandlung erreicht (Abb. 3). Auch in Kohorte B und in der Gesamtpopulation (Kohorten A und B) ergaben sich Überlebensvorteile für Olaparib (Hussain et al., 2020).
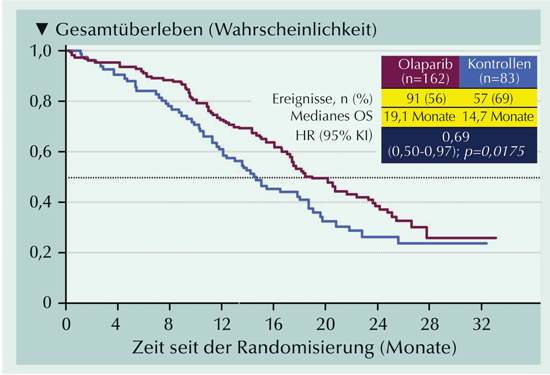
|
Abb. 3: Wahrscheinlichkeit des Gesamtüberlebens der Patienten in der Intention-to-Treat-Population, die zumindest eine Mutation im BRCA1-, BRCA2- oder ATM-Gen (Kohorte A) hatten (nach Hussain et al., 2020). |
PROpel: In der randomisierten, doppelblinden Multicenterstudie der Phase III, wurden Effektivität, Sicherheit und Tolerierbarkeit von Olaparib versus Placebo jeweils zusammen mit Abirateron (plus Prednison oder Prednisolon), bei Männern mit mCRPC untersucht, die im bereits kastrationsresistenten Stadium zuvor keine Chemotherapie oder einen ARSI erhalten hatten (Clarke et al., 2018). Die Eignung der aufgenommenen Patienten war vom Mutationsstatus der homologen Rekombinationsreparatur unabhängig. Dieser wurde durch Tests von Tumorgewebe und der zirkulierenden Tumor-DNA (ctDNA) bestimmt. Als primärer Endpunkt war das vom Prüfarzt ermittelte radiographische progressionsfreie Überleben (rPFS) festgelegt worden. Sekundär waren das Gesamtüberleben, die Zeit bis zur sekundären Progression oder Tod sowie die Zeit bis zur ersten nachfolgenden Therapie von Interesse.
Die primäre Analyse (49,5% reif) beruht auf den Daten von 394 Patienten, die ein PFS-Ereignis hatten oder gestorben waren. Das mediane rPFS war im (Abirateron + Olaparib)-Arm signifikant länger als im (Abirateron + Placebo)-Arm (24,8 vs. 16,6 Monate; HR, 0,66; p <0,001) (Abb. 4). Die vorgeplante Sensitivitätsanalyse des PFS durch einen verblindeten zentralen Review stimmte mit der Primäranalyse überein (median 27,6 vs. 16,4 Monate; HR, 0,61) (Clarke et al., 2022; Saad et al., 2022).
In der vorgegebenen finalen Analyse von PROpel bestand in der Intention-to-treat (ITT)-Population mit Abirateron + Olaparib vs. Abirateron + Placebo der stetige Trend zu einem Benefit des OS (hauptsächlicher sekundärer Endpunkt: Reife 47,9%; Abb. 5) (Clarke et al., 2023).
|
Zulassung von Olaparib und Olaparib plus Abirateron für Prostatakrebs
Noch im Jahr 2020 empfahl die European Medicines Agency (EMA) Olaparib für Prostatakrebs-Patienten mit Progress nach einer
ARSI-enthaltenden Therapie. Hauptsächliche Voraussetzung ist die Feststellung einer BRCA 1-/BRCA 2-Mutation (somatisch
oder in der Keimbahn).
Die EMA-Zulassung von Olaparib in Kombination mit Abirateron plus Prednisolon erfolgte im Dezember 2022 für mCRPC-Patienten bei denen eine Chemotherapie klinisch nicht indiziert ist.
Weitere PARP-Inhibitoren in der Prüfung beim Prostatakarzinom
TALAPRO-1: In der Phase-II-Open-label-Studie hatten vorbehandelte Patienten mit progredientem adenokarzinomatösem mCRPC und DDR-Mutationen (z.B. ATM, ATR, BRCA1, BRCA2, CHEK2, FANCA, MLH1, MRE11A, NBN, PALB2, RAD51C) mit oralem Talazoparib anhaltende Antitumoraktivität. Das vorteilhafte Nutzen-Risiko-Profil sprach für die Untersuchung von Talazoparib in größeren, randomisierten klinischen Studien auch bei Patienten mit Mutationen in anderen für die DNA-Reparatur wichtigen Genen als den BRCA-Genen (de Bono et al., 2021).
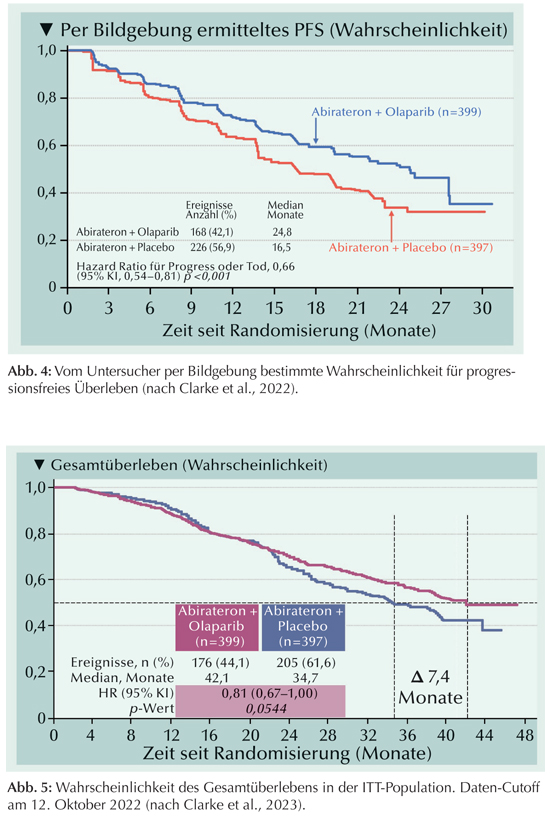
TALAPRO-2: Die randomisierte, doppelblinde, placebokontrollierte Phase-III-Studie diente der Prüfung von Talazoparib plus Enzalutamid als erste Therapielinie bei mCRPC-Patienten (Fizazi et al., 2023).Die Patienten wurden auf zwei sich überlagernde Kohorten randomisiert (Abb. 6): In Kohorte 1 wurden 636 Patienten als „All-comers“ mit nicht defizientem oder nicht bekanntem Metastasen-Status der homologen Rekombinationsreparaturgene (HRR) mit 169 HRR-mutierten Patienten ergänzt. In Kohorte 2 wurden alle Patienten mit einer HRR-Mutation zusammengefasst. Bei der Behandlung mit Talazoparib plus Enzalutamid versus Placebo plus Enzalutamid handelt sich um eine echte Erstlinientherapie, da in der kastrationsreshatten im hormonsensitiven Stadium Abirateron und 28,5 bzw. 30,2% Docetaxel erhalten. Primärer Endpunkt von TALAPRO-2 war das durch einen zentralen Review nach RECIST festgestellte radiographische progressionsfreie Ansprechen (rPFS).
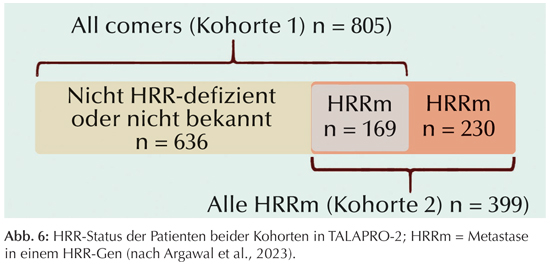
|
An HRR-Gen-Alterationen waren am häufigsten Mutationen von BRCA2 (31,0 bzw. 36,7%), ATM (23,5 bzw. 19,6%), CDK12 (18,0 bzw. 19,6) und CHEK2 (17,0 bzw. 18,6%) festgestellt worden.
In der vorgegebenen Analyse war das mediane rPFS bei Zusatz von Talazoparib noch nicht erreicht. In der Placebokohorte waren es 21,9 Monate. Das Hazard Ratio für rPFS betrug 0,63 (p<0,001). Das Risiko für einen Progress oder Tod wurde durch die zusätzliche Gabe von Talazoparib zu Enzalutamid um 55% reduziert (HR=0,45; p<0,0001) (Abb. 7). Der Median betrug im Placeboarm 13,8 Monate und war im Talazoparib-Arm noch nicht erreicht. Der Effektivitätsvorteil der Talazoparib-Kombination wurde für alle präspezifizierten Subgruppen bestätigt (Fizzazi et al., 2023).
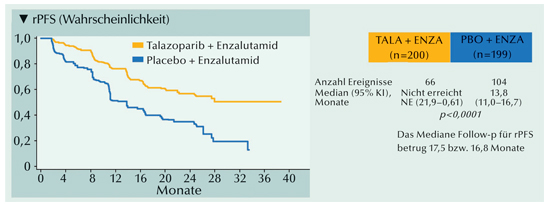
|
Abb. 7: Progressionsfreies Überleberleben (rPFS) bei HRR-defizienter Erkrankung unter Talazoparib plus Enzalutamid versus Placebo plus Enzalutamid (mod. nach Fizazi et al., 2023). |
GALAHAD: In der multizentrischen, einarmigen Open-label-Studie der Phase II entwickelte Niraparib bei schwer vorbehandelten mCRPC-Patienten mit DDR-Defekt bedeutsame Antitumor-Aktivität – insbesondere bei Vorliegen einer BRCA-Alteration. Dabei wurde die Behandlung mit Niraparib als tolerierbar bewertet. Primärer Endpunkt von GALAHAD war die objektive Ansprechrate (ORR) bei Patienten mit BRCA-Mutation und messbarer Krankheit (Smith et al., 2022).
Die ORR in der messbaren BRCA-Kohorte erreichte 34,2% (26 von 76 Patienten) mit einem medianen Follow-up von 10,0 Monaten. Von den 76 Patienten der BRCA-Kohorte mit messbarer Krankheit gab es in 35 (46,1%) Fällen zumindest ein Partialansprechen (30% Abnahme). Die mediane Dauer des objektiven Ansprechens betrug 5,55 Monate. Bei 8 der 26 Responder (30,8%) fielt das Ansprechen zum Zeitpunkt des Daten-Cutoff weiterhin an.
MAGNITUDE: In der Phase-III-Studie wurden Patienten mit mCRPC als HRR+ mit/ohne BRCA1/2-Mutation identifiziert und 1:1 zur Erstlinienbehandlung in eine Gruppe mit Niraparib plus Abirateronacetat plus Prednisolon (AAP) und eine Gruppe mit Placebo plus AAP randomisiert. Als primärer Endpunkt war das radiographische progressionsfreie Überleben (rPFS) festgelegt worden (Chi et al., 2023).
Bei der zweiten vorgegebenen Interimsanalyse nach 24,8 Monaten dauerte das rPFS gemäß dem verblindeten, unabhängigen, zentralen Review in der BRCA1/2-Subgruppe mit Niraparib plus AAP versus der mit Placebo plus AAP signifikant länger (9,5 bzw. 10,9 Monate) HR, 0,55; p=0,0007 (Chi et al., 2023).
Die Empfehlung der EMA für die Zulassung von Niraparib erfolgte für die Kombination mit Abirateronacetat in Form einer Dual-Action-Tablette plus Prednisolon zur Behandlung von erwachsenen Patienten mit mCRPC und BRCA1/2-Mutationen (Keimbahn und/oder somatisch), bei denen eine Chemotherapie klinisch nicht indiziert ist.
TRITON2: In der Phase-II-Studie wurde Rucaparib zur Behandlung bei Männern mit mCRPC und einer BRCA-Mutation mit und ohne messbare Krankheit bewertet. Hierfür wurden Patienten eingeschlossen, die nach einer oder zwei Linien einer gegen den Androgenrezeptor gerichteten Therapie der zweiten Generation und einer Taxan-basierten Chemotherapie progredient geworden waren. Als primärer Endpunkt war die von einem verblindeten, unabhängigen Radiologie-Review bestätigte objektive Ansprechrate (ORR) nach modifiziertem RECIST v1.1 gewählt worden (Abida et al., 2020).
Ein beträchtlicher Anteil Patienten erreichte mit der Rucaparib-Behandlung sowohl beim unabhängigen, zentralen Radiologie-Review als auch beim Prüfarzt ein bestätigtes radiographisches Ansprechen – 43,5% (27 von 62 Patienten) bzw. 50,8% (33 von 65 Patienten). Die ORR war bei Patienten mit einer Keimbahn- oder somatischen BRCA-Alteration wie auch bei Patienten mit einer BRCA1- oder BRCA2-Alteration vergleichbar. Die bestätigte PSA-Ansprechrate betrug 54,8% (63 von 115 Patienten). Patienten mit einer BRCA2-Alteration hatten eine höhere PSA-Ansprechrate als Patienten mit einer BRCA1-Alteration (Abida et al., 2020).
Autor: Prof. Dr. Dr. Joachim F. Schindler
Literatur:
Abida W, Patnaik A, Campbell D, et al. 2020. Rucaparib in men with metastatic castration-resistant prostate cancer harboring a BRCA1 or BRCA2 gene alteration. J Clin Oncol 38(32):3763–3772.
Agarwal N, Azad A, Carles J, et al. 2023. TALAPRO-2: Phase 3 study of talazoparib (TALA) + enzalutamide (ENZA) versus placebo (PBO) + ENZA as first-line (1L) treatment in patients (pts) with metastatic castration-resistant prostate cancer (mCRPC). J Clin Oncol 41(6_suppl):LBA17–LBA17.
Armenia J, Wankowicz SAM, Liu D, et al. 2018. The long tail of oncogenic drivers in prostate cancer. Nat Genet 50:645–651.
Bryant HE, Schultz N, Thomas HD, et al. 2005. Specific killing of BRCA2-deficient tumours with inhibitors of poly(ADP-ribose) polymerase. Nature (2005) 434:913–917.
Bryant HE, Petermann E, Schultz N, et al. 2009. PARP is activated at stalled forks to mediate Mre11-dependent replication restart and recombination. EMBO J 28:2601–2615.
Chen A, 2011. PARP inhibitors: its role in treatment of cancer. Chin J Cancer 30:463–471.
Chi KN. Sandhu S, Smith MR, et al. 2023. Niraparib plus abiraterone acetate with prednisone in patients with metastatic castration-resistant prostate cancer and homologous recombination repair gene alterations: second interim analysis of the randomized phase III MAGNITUDE trial. Ann Oncol 34:772–782.
Clarke N, Wiechno P, Alekseev B, et al. 2018. Olaparib combined with abiraterone in patients with metastatic castration-resistant prostate cancer: a randomised, double-blind, placebo-controlled, phase 2 trial. Lancet Oncol 19:975–986.
Clarke NW, Armstrong AJ, Thiery-Vuillemin A, et al. 2022. Abiraterone and olaparib for metastatic castration-resistant prostate cancer. NEJM Evid 2022:1.
Clarke NM, Armstrong AJ, Thiery-Vuillemin A, et al. 2023. Final overall survival (OS) in PROpel: Abiraterone (abi) and olaparib (ola) versus abiraterone and placebo (pbo) as first-line (1L) therapy for metastatic castration-resistant prostate cancer (mCRPC). J Clin Oncol 41(6_suppl.) LBA16–LBA16.
Dan R, Van Allen EM, Wu Y-M, et al. 2015. Integrative clinical genomics of advanced prostate cancer. Cell 161:1215–1228.
de Bono J, Mateo J, Fizazi K, et al. 2020. Olaparib for metastatic castration-resistant prostate cancer. N Engl J Med 382:2091–102.
de Bono JS, Mehra N, Scagliotti GV, et al. 2021. Talazoparib monotherapy in metastatic castration-resistant prostate cancer with DNA repair alterations (TALAPRO-1): an open-label, phase 2 trial. Lancet Oncol 22:1250–1264.
Farmer H, McCabe N, Lord CJ, et al. 2005. Targeting the DNA repair defect in BRCA mutant cells as a therapeutic strategy. Nature 434:917–921.
Fizazi K, Azad A, Matsubara N, et al. 2023. TALAPRO-2: Phase 3 study of talazoparib (TALA) + enzalutamide (ENZA) versus placebo (PBO) + ENZA as first-line (1L) treatment for patients (pts) with metastatic castration-resistant prostate cancer (mCRPC) harboring homologous recombination repair (HRR) gene alterations. J Clin Oncol 41(6_suppl):5004-5004.
Fong PC, Boss DS, Yap TA, et al. 2009. Inhibition of poly(ADP-ribose) polymerase in tumors from BRCA mutation carriers. N Engl J Med 361:123–134.
Gallagher DJ, Gaudet MM, Pal P, et al. 2010. Germline BRCA mutations denote a clinicopathologic subset of prostate cancer. Clin Cancer Res 16:2115–2121.
Gui B, Gui F, Takaia T, et al. 2019. Selective targeting of PARP-2 inhibits androgen receptor signaling and prostate cancer growth through disruption of FOXA1 function. PNAS 116:14573–14582.
Hussain M, Mateo J, Fizazi K, et al. 2020. Survival with Olaparib in Metastatic Castration-Resistant Prostate Cancer. N Engl J Med 383:2345–2357.
Kote-Jarai Z, Leongamornlert D, Saunders E, et al. 2014. BRCA2 is a moderate penetrance gene contributing to young-onset prostate cancer: implications for genetic testing in prostate cancer patients. Br J Cancer 105:1230–1234.
Kraus WL, 2015. PARPs and ADP-ribosylation: 50 years … and counting. Mol Cell 58:902–910.
Leongamornlert D, Saunders E, Dadaev T, et al. 2014. Frequent germline deleterious mutations in DNA repair genes in familial prostate cancer cases are associated with advanced disease. Br J Cancer 110:1663–1672.
Mateo J, Carreira S, Sandhu S, et al. 2015. DNA-repair defects and olaparib in metastatic prostate cancer. N Engl J Med 373:1697–1708.
Mateo J, Porta N, Bianchini D, et al. 2020. Olaparib in patients with metastatic castration-resistant prostate cancer with DNA repair gene aberrations (TOPARP-B): a multicentre, open-label, randomised, phase 2 trial. Lancet Oncol 21:162–174.
Mendes-Pereira AM, Martin SA, Brough R, et al. 2009. Synthetic lethal targeting of PTEN mutant cells with PARP inhibitors. EMBO Mol Med 1:315–322.
Patel AG, Sarkaria JN, Kaufmann SH 2011. Nonhomologous end joining drives poly(ADP-ribose) polymerase (PARP) inhibitor lethality in homologous recombination-deficient cells. PNAS 108:3406–3411.
Pritchard CC, Mateo J, Walsh MF, et al. 2016. Inherited DNA-repair gene mutations in men with metastatic prostate cancer. N Engl J Med 375:443–453.
Rose M, Burgess JT, O’Byrne K, et al. 2020. PARP inhibitors: Clinical relevance, mechanisms of action and tumor resistance. Front Cell Dev Biol 8: 564601.
Saad F, Armstrong AJ, Thiery-Vuillemin A, et al. 2022. PROpel: Phase III trial of olaparib (ola) and abiraterone (abi) versus placebo (pbo) and abi as first-line (1L) therapy for patients (pts) with metastatic castration-resistant prostate cancer (mCRPC). J Clin Oncol 40(6_suppl):11–11.
Schiewer MJ, Goodwin JF, Han S, et al. 2012. Dual roles of PARP-1 promote cancer growth and progression. Cancer Discov 2:1134–1149.
Smith MR, Scher HI, Sandhu S, et al. 2022. Niraparib in patients with metastatic castration-resistant prostate cancer and DNA repair gene defects (GALAHAD): a multicentre, open-label, phase 2 trial. Lancet Oncol 23:362–373.
Sourisseau T, Maniotis D, McCarthy A, et al. 2010. Aurora-A expressing tumour cells are deficient for homology-directed DNA double strand-break repair and sensitive to PARP inhibition. EMBO Mol Med 2:130–142.
Taylor AK, Kosoff D, Emamekhoo H, et al. 2023. PARP inhibitors in metastatic prostate cancer. Front Oncol 13:1159557.
Teyssonneau D, Margot H, Cabart M, et al. 2021. Prostate cancer and PARP inhibitors: progress and challenges. J Hematol Oncol 14:51.
Weston WJ, Oldreive CE, Skowronska A, et al. 2010. The PARP inhibitor olaparib induces significant killing of ATM-deficient lymphoid tumor cells in vitro and in vivo. Blood 116 (22): 4578–4587.
 jfs
jfs
© 2003-2025 pro-anima medizin medien
–
impressum
–
mediadaten
–
konzeption
–
datenschutz