
Etablierte und potenzielle hormonelle, zytotoxische, targeted und Immuntherapien
Auch sechs Jahre nach der Einführung von Docetaxel als Standardtherapie bei kastrationsresistentem Prostatakrebs hat sich noch keine weitere Substanz als effektiver herausgestellt. Die Hoffnung auf eine Verlängerung der Überlebenszeit ruht insbesondere auf Kombinationen von Docetaxel mit targeted Therapien. Wesentlich ist auch noch eine allgemein anerkannte Option für die Second-line-Therapie.
Prostatakrebs gilt in den westlichen Industrieländern als zweithäufigste krebsbedingte Todesursache, obwohl das
Fünfjahres-
Rolle des Androgenrezeptors auch bei Kastrationsresistenz
-
Nach Kastration wie auch unter einer Androgendeprivationstherapie sinkt der Serum-Testosteronspiegel zwar auf sehr tiefe
Werte ab, doch intraprostatisch wurden Androgenspiegel gemessen, bei denen die Expression verschiedener Androgen-regulierter
Gene nicht hinreichend effektiv supprimiert ist [6]. Dennoch kommt es anfänglich in einem hohen Prozentsatz der Fälle zu
einem Rückgang des Tumorwachstums, bevor sich die Krankheit meist nach ein bis zwei Jahren durch die Ausschaltung der
testikulären Testosteronproduktion allein nicht länger kontrollieren lässt. Prostatakrebs, der trotz eines Serum-Testosteronspiegels
auf Kastrationsniveau (definitionsgemäß <50 ng/ml) progredient geworden ist, wird als kastrationsresistent bezeichnet.
Dieses klinische Stadium manifestiert sich meist durch ein Ansteigen des Prostata-spezifischen Androgen (PSA)-Spiegels
und der Absiedelung von Knochenmetastasen, was häufig mit Skelettkomplikationen begleitet von beträchtlichen Schmerzen
verbunden ist. Zudem treten vielfach Lymphknotenmetastasen auf.
Auch im Stadium der Kastrationsresistenz wird die Progression des Prostatakrebses über die Aktivierung des Androgenrezeptors (AR) vorangetrieben. Hierbei können Androgene aus den Nebennierenrinden und durch die Prostatakrebszellen selbst produzierte Androgene eine Rolle spielen [7]. Die Synthese intrakriner Androgene wird durch Interleukin-6 reguliert und beruht auf der vermehrten Bildung von Enzymen des Androgenmetabolismus [8].
Die Aktivierung des AR bei kastrationsresistentem Prostatakrebs wurde über verschiedene Mechanismen zu erklären versucht. Hierzu zählen die Mutation und Amplifikation des AR-Gens, Aktivierung des AR durch nicht-androgene Faktoren wie Interleukin-6 und den Insulin-ähnlichen Wachstumsfaktor-1, sowie eine veränderte Expressionsrate von transkriptorischen Koregulatoren wie die Überexpression von Koaktivatoren und die Downregulierung der Expression von Korepressoren.
In einer aktuellen Phase-I/II-Studie mit den AR-Antagonisten MDV3100 in unterschiedlicher Konzentration bestätigte sich,
dass auch beim kastrationsresistenten Prostatakarzinom weiterhin eine Abhängigkeit von der Signalübertragung via AR
besteht [9]. Anti-Tumoreffekte wurden bei MDV3100-Dosen zwischen täglich 60 mg und 480 mg registriert:
Bei mehr als der Hälfte der Patienten kam es zum Abfall des PSA-Spiegels um 50% und darüber hinaus. Ähnlich häufig stabilisierte
sich die ossäre Beteiligung und die Zahl der zirkulierenden Tumorzellen reduzierte sich auf ein vorteilhaftes Niveau. Die Zeit bis
zur Progression betrug im Mittel 47 Wochen. Bei maximal 240 mg MDV3100 konnte die Therapie für länger als 28 Tage aufrechterhalten
werden. Als häufigstes unerwünschtes Ereignis trat dosisabhängig und reversibel Fatigue vom Grad 3/4 (11%) auf.
-
Untersuchungen an immortalisierten Prostatakrebszellen und Ergebnisse aus Tierexperimenten haben ergeben, dass es im
Krankheitsverlauf von Prostatakrebs zur Veränderung molekularer Mechanismen in Verbindung mit der AR-vermittelten Transkription
androgenabhängiger Gene kommt. Insbesondere im kastrationsresistenten Stadium führt der vielfach beobachtete Verlust der
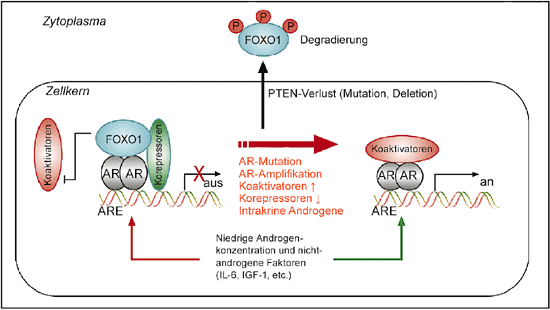
Tumorsuppressorfunktion von PTEN (phosphatase and tensin homolog) zu promiskuitiver Aktivierung des AR. Hierbei spielt
die Phosphorylierung und nukleäre Exklusion des Forkhead-Proteins FOXO1, das im Zellkern inhibitorische Effekte am AR hat,
offenbar eine zentrale Rolle. Bleiben diese inhibitorischen Impulse aus, vermitteln zahlreiche Faktoren transkriptorische
AR-Aktivität – es ist sozusagen der Schwellenwert für die AR-Aktivierung herabgesetzt [10] (Abb. 1).
|
Abb. 1: Vorgeschlagener molekularer Mechanismus, der den Übergang von der Aktivierung des Androgenrezeptors in der normalen Prostataepithelzelle zur promiskuitiven AR-Aktivierung insbesondere bei kastrationsresistentem Prostatakrebs darstellt. Hierbei können Mutationen des AR-Gens, eine Amplifikation des AR-Gens, die Überexpression von Koaktivatoren des AR-Gens, die Downregulation von Korepressoren und die intraprostatische Bildung von Androgenen eine Rolle spielen. Bei Verlust der Funktion des Tumorsuppressorproteins PTEN durch Mutation oder Deletion kommt es zur Lösung des Forkhead-Transkriptionsfaktors FOXO1 vom AR-Transaktivierungskomplex, dessen Phosphorylierung und enzymatische Degradierung im Zytoplasma. ARE = Androgen-Response-Element (nach Jinang J, Huang H, 2010). |
Durch die Behandlung kultivierter Zellen aus einem kastrationsresistenten Prostatakarzinom (22Rv1) mit einem Taxan in sehr niedriger Konzentration lässt sich die Expressionsrate androgenabhängiger Gene (u.a. PSA) supprimieren und zugleich die Expressionsrate von Maspin eines AR-Repressors zu erhöhen [11]. In diesem Zusammenhang wurde auch demonstriert, dass Paclitaxel in 22Rv1-Zellen die Akkumulation von FOXO1 in Prostatakrebszellen und dessen Komplexierung mit dem AR induziert. Darüber hinaus wurden auch vermehrt FOXO1-Proteine am Promotor des PSA-Gens in mit Paclitaxel behandelten Zellen nachgewiesen. Die FOXO1-vermittelten AR-inhibitorischen Taxan-Effekte könnten bei kastrationsresistentem Prostatakrebs bei der zytotoxischen Wirksamkeit von Taxanen eine Rolle spielen.
-
Bei Prostatakrebs sind zahlreiche molekulare Signalwege involviert, die als potenzielle Angriffsziele für targeted Therapien
in Frage kommen. Zu den prominentesten gehören der AR selbst, der vaskuläre endotheliale Wachstumsfaktor-Rezeptor (VEGFR),
der Endothelin-A-Rezeptor (ETA-R) und epidermale Wachstumsfaktor-Rezeptoren.
Die Rationale für eine Anwendung von ETA-R-Antagonisten wie Zibotentan beim metastasierten Prostatakarzinom liegt
darin begründet, dass Endothelin-A bei Knochenmetastasen die Osteoblastenaktivität begünstigt. Darüber hinaus wirkt ET
anti-apoptotisch, und es fördert die Tumorangiogenese wie auch die Tumorinvasion.
Zibotentan
In einer randomisierten, Placebo-kontrollierten Phase-II-Studie wurden Effektivität und Sicherheit einer Behandlung mit
Zibotentan, einem selektiven ETA-R-Antagonisten, bei Patienten mit kastrationsresistentem Prostatakrebs und Knochenmetastasen,
die schmerzfrei waren oder nur leichte Symptome zeigten, untersucht [12]: Zwischen Placebo und Zibotentan in zwei Dosierungen
bestand bezüglich der medianen Zeit bis zur Progression, die als primärer Endpunkt definiert worden war, kein statistisch
signifikanter Unterschied. Bemerkenswerterweise stellte sich aber bei der Analyse des Gesamtüberlebens ein Vorteil für Zibotentan
heraus, der bereits nach 40 Todesfällen erkennbar war, und der sich nach 118 Todesfällen bestätigte. Die Autoren glauben, dass
die Diskrepanz zwischen der Zeit bis zur Progression und dem Gesamtüberleben auf ihre sehr sensitive Definition von Progession
zurückzuführen sein könnte.
Angesichts des positiven Ergebnisses hinsichtlich Gesamtüberleben wurden zwei große Phase-III-Studien mit Zibotentan initiiert:
Zibotentan plus Docetaxel beim metastasierten hormonresistenten Prostatakrebs (ENTHUSEM1C) und Zibotentan als Monotherapie
(ENTHUSEM MO).
-
Bis zur Mitte der 1990er Jahre galt Prostatakrebs als refraktär gegenüber Chemotherapien. Doch dann belegten zunächst Studien
mit Mitoxantron, dass zytotoxische Therapien durchaus in der Lage sind, bei kastrationsresistentem Prostatakrebs palliative
Wirkungen zu erzielen. In der Kombination mit Prednison verschafft Mitoxantron den Patienten häufiger als Prednison allein
Schmerzerleichterung und reduziert die Notwendigkeit des Einsatzes analgetischer Präparate.
Im nächsten Schritt wurde das therapeutische Potenzial der Taxane bei kastrationsresistentem Prostatakrebs ausgelotet. Die
Ergebnisse von Phase-I/II-Studien zeigten für Docetaxel-basierte Regime höhere Ansprechraten als sie zuvor mit Mitoxantron
erreicht worden waren. Insbesondere betrug das mediane Überleben von Patienten, die dreiwöchentlich Docetaxel erhielten,
bis zu 27 Monate.
Docetaxel plus Prednison
Im Jahr 2004 bestätigten die Ergebnisse zweier großer, randomisierter Phase-III-Studien unabhängig voneinander den
Überlebensvorteil für Patienten mit kastrationsresistentem Prostatakrebs, die bei einer Behandlung mit Docetaxel gegenüber
der mit Mitoxantron: Die TAX 327-Studie diente dem Vergleich Docetaxel dreiwöchentlich (q3w, 75 mg/m2) sowie Docetaxel
wöchentlich (q1w, 30 mg/m2 5 von 6 Wochen) mit Mitoxantron dreiwöchentlich (q3w, 12 mg/m2) jeweils in Kombination mit
zweimal täglich 5 mg Prednison. Dabei ergab sich für die dreiwöchentlich mit Docetaxel behandelten Patienten eine signifikante
Verringerung des Sterberisikos von 24% [13]. Die First-line-Therapie des kastrationsresistenten Prostatakarzinoms erfolgt
daher heute standardmäßig mit dreiwöchentlichen Zyklen von Docetaxel in Kombination mit täglich Prednison.
In der Studie SWOG 99-16 wurde die Kombination Docetaxel/Estramustin im Vergleich zu Mitoxantron plus Prednison verglichen. Die Reduktion des Sterberisikos bei den mit Docetaxel/Estramustin behandelten Patienten betrug 20% [14].
Mit keiner zugelassenen Substanz konnte bis dato in einer Phase-III-Studie ein günstigeres Krankheitsergebnis bei Patienten
mit kastrationsresistentem Prostatakrebs erzielt werden.
Epothilone
Epothilone besitzen eine pharmakologische Wirkung als Zytostatika. Ihr Wirkmechanismus beruht in ähnlicher Weise wie bei
den Taxanen auf der Stabilisierung von Mikrotubuli, wodurch es zu einem Arrest im Zellzyklus in der M/G2-Phase kommt.
Mit verschiedenen Vertretern dieser Substanzklasse (Ixabepilon, Patupilon, Sagopilon) wurden Phase-II-Studien bei
kastrationsresistentem Prostatakrebs unternommen. Von Patienten, die als primäre Chemotherapie Ixabepilon erhielten,
zeigten 33% ein PSA-Ansprechen. Randomisierte, Placebo-kontrollierte Studien mit Epothilonen gibt es bislang nicht – es
laufen gegenwärtig auch keine.
-
Für Patienten mit metastasiertem kastrationsresistentem Prostatakrebs sind bislang keine prädiktiven Faktoren für das
Ansprechen auf eine Chemotherapie bekannt. Diesbezüglich wurde anhand von Daten der mit Docetaxel behandelten Patienten
der TAX 327-Studie vier unabhängige vor der Behandlung bestehende Risikofaktoren identifiziert, die als Prädiktoren einer
zumindest 30%igen Senkung des PSA-Spiegels herangezogen werden können: Schmerzen, viszerale Metastasen, Anämie und
Progression im Knochen-Scan. Sie dienten der Entwicklung von drei Risikogruppen (gut: 0-1 Faktor, intermediär: 2 Faktoren,
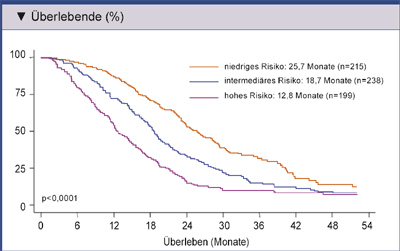
schlecht 3-4 Faktoren) mit einem medianen Gesamtüberleben von 25,7, 18,7 bzw. 12,8 Monaten (Abb. 2). Die objektiven
Ansprechraten in den drei Gruppen betrugen 19%, 9% und 5%.
|
Abb. 2: Kaplan-Meier-Gesamtüberlebenskurven gesondert nach der Klassifizierung in gering, intermediär und hohes Risiko (nach Armstrong AJ, et al. 2010). |
Zur Validierung des Modells dienten die mit Mitoxantron behandelten Männer der TAX 327-Studie. Sowohl für die 30%ige PSA-Absenkung, das Ansprechen als auch das Gesamtüberleben wurde eine ähnliche prädiktive Leistungsfähigkeit ermittelt [15].
-
Substanzen aus verschiedenen Wirkstoffklassen haben in präklinischen Untersuchungen synergistische oder additive
Aktivität mit dem Mikrotubuli-Stabilisator und Spindelgift Docetaxel erkennen lassen. Als Kombinationspartner für
Docetaxel wurden insbesondere Tyrosinkinase-Inhibitoren, antiangiogene Substanzen, Viatmin-D-Analoga, Inhibitoren
des antiapoptotischen Proteins Bcl-2, Chemotherapeutika und immunologische Substanzen zumeist in Phase-II-Sudien
auf ihre Eignung hin untersucht. In einem Übersichtsartikel referieren Galsky und Vogelzang (2010) erschöpfend
Studienergebnisse mit Docetaxel-basierten Kombinationstherapien [16].
Docetaxel, Estramustin und Hydrocortison
Die Kombination Docetaxel-Estramustin-Hydrocortison bei hormonrefraktärem Prostatakrebs führte bei 32 Patienten (51%) zu einer mehr als 50%igen Reduktion des PSA-Spiegels. In 18 Fällen (29%) betrug die Absenkung des PSA-Spiegels sogar mehr als 90%. Die mediane Zeit bis zur Progression betrug sechs Monate (1-41 Monate), und die Mediane Überlebenszeit belief sich auf 14 Monate (1-56 Monate). Das Regime wurde als relativ sicher eingestuft, obwohl 87% der Patienten eine Neutropenie Grad 3/4 erlitten, bei einem Patienten eine interstitielle Pneumonie Grad 5 auftrat und in zwei Fällen ein Myokardinfarkt Grad 4/5 verzeichnet wurde [17].
Docetaxel plus Sunitinib
Die Kombination von Docetaxel mit dem gegen multiple Ziele gerichteten Tyrosinkinase-Hemmer Sunitinib und Prednison wurde bei Patienten mit kastrationsresistentem Prostatakrebs unter Phase-II-Bedingungen geprüft [18]. Von 33 Patienten mit messbarer Krankheit sprachen 19 (39 %) bestätigtermaßen partiell an, und bei weiteren sieben Patienten (21%) wurde anfänglich ein partielles Ansprechen registriert. Bei der Vorstellung der Ergebnisse auf dem ASCO 2009 waren das mediane progressionsfreie und Gesamtüberleben noch nicht erreicht. Die Überlebenswahrscheinlichkeit nach 48 Wochen betrug 92,4%. Von Neutropenie, der häufigsten Nebenwirkung vom Grad 3/4, waren drei von vier Patienten betroffen.
-
Für Patienten mit kastrationsresistentem Prostatakrebs, bei denen die Krankheit nach einer First-line-Therapie mit einer
Docetaxel-basierten Chemotherapie progredient wird, gibt es bis dato keine zugelassene Second-line-Therapie. In neueren
Studien wurden diesbezüglich eine Reihe potentieller Optionen geprüft:
Cabazitaxel plus Prednison
Cabazitaxel ist ein neues, noch in der klinischen Prüfung befindliches Taxan. Von ihm wird eine zytotoxische Wirksamkeit auch bei Zelllinien erwartet, die normalerweise auf Taxane nicht ansprechen.
Auf dem ASCO 2010 wurden die Ergebnisse der Phase-III-Zulassungsstudie (TROPIC) präsentiert, an der 146 Zentren in 26 Ländern (darunter auch in Deutschland) beteiligt waren [19]. Bei 755 Patienten mit metastasiertem hormonrefraktärem Prostatakrebs, deren Erkrankung unter oder nach einer Docetaxel-basierten First-line-Therapie fortgeschritten war, wurden mit täglich 10 mg Prednison in Kombination mit entweder dreiwöchentlich 12 mg/m2 Mitoxantron oder 25 mg/m2 Cabazitaxel behandelt. Primärer Endpunkt der Studie war das Gesamtüberleben.
Nach einem mittleren Follow-up von 12,8 Monaten ergab sich für den Studienarm gegenüber dem Vergleichsarm ein um 28% geringeres Mortalitätsrisiko. Das mediane Gesamtüberleben betrug bei den mit Cabazitaxel behandelten Patienten 15,1 Monate und bei den mit Mitoxantron behandelten Patienten 12,7 Monate.
Die Behandlung mit Cabazitaxel verursachte eine hohe Rate an Neutropenien Grad 3/4 (81,7%) gegenüber 58% mit Mitoxantron.
Aufgrund der positiven Ergebnisse wird erwartet, dass Cabazitaxel in der Second-line-Therapie von kastrationsresistentem
Prostatakrebs eine Rolle spielen wird.
Wiederbehandlung mit Docetaxel
Anhand der Krankenberichte von Patienten mit kastrationsresistentem Prostatakrebs, die an sieben verschiedenen kontrollierten
klinischen Studien mit Docetaxel als First-Line-Therapie teilgenommen hatten, wurden 50 bestätigte Responder identifiziert,
die die Therapie nicht fortgesetzt hatten. Ihre Gründe für den Abbruch waren andere als die Progression der Krankheit oder
untolerierbare Toxizität. Alle Männer erhielten eine weitere Therapie mit Docetaxel [20]: Bei der First-line-Therapie betrug
die mittlere Behandlungsdauer 10,3 (4,6-45,7) Monate. Das mittlere Docetaxel-freie Intervall dauerte im Mittel 18,4 (5,0-46,7)
Monate. Bei 24 Patienten (48%) wurde eine 50 %ige Reduktion des PSA-Spiegels registriert. Das mittlere Gesamtüberleben nach
Wiederaufnahme der Docetaxel-Therapie belief sich auf 16 (13-20) Monate. Nicht zuletzt auch aufgrund eines günstigen
Toleranzprofils glauben die Autoren, dass bei Patienten mit kastrationsresistentem Prostatakrebs, die auf eine
First-line-Therapie mit Docetaxel angesprochen haben, von einer Wiederaufnahme der Therapie profitieren können.
Satraplatin plus Prednison
Die Ergebnisse der Satraplatin and Prednisone Against Refractory Cancer Trial (SPARC) ergaben als Second-line-Therapie bei
Patienten mit Chemotherapie vorbehandeltem kastrationsresistentem Prostatakrebs zwar eine signifikante Verlängerung des
progressionsfreien Überlebens, doch es wurden keine Vorteile beim Gesamtüberleben registriert [21]: Die
950 Patienten der Phase-III-Studie erhielten randomisiert entweder 80 mg/m2 orales Satraplatin (n=635) an den Tagen
1 und 5 eines 35-tägigen Zyklus plus zweimal täglich 5 mg Prednison oder Placebo (n=315) plus Prednison.
Die mittlere Dauer des progressionsfreien Überlebens betrug im Satraplatin-Arm 11,1 Wochen gegenüber 9,7 Wochen im
Placebo-Arm (p<0,001). Das mittlere Gesamtüberleben – der zweite festgelegte primäre Endpunkt – betrug in der
Intention-to-Treat-Population im Satraplatin-Arm 61,3 Wochen und im Placebo-Arm 61,4 Wochen. Die Therapie mit
Satraplatin wurde trotz vermehrten Auftretens von Myelosuppression und gastrointestinalen Beschwerden allgemein
gut toleriert.
Carboplatin plus Taxan
Carboplatin allein hat bei kastrationsresistentem Prostatakrebs nur moderate Aktivität. Ihm wird aber in Verbindung mit
Taxanen ein höherer Nutzen beigemessen. Eine gepoolte Analyse aus den Daten von sieben Studien mit der Dreierkombination
Taxan-Estramustin-Carboplatin zeigte zwar ein vorteilhaftes Gesamtüberlebensprofil, doch es ließ sich nicht klar ermitteln,
ob der Benefit dem Taxan alleine oder einer Wirkungssteigerung durch die Kombination mit Carboplatin zuzuschreiben
ist [22].
Sunitinib
Sunitinib inhibiert verschiedene Tyrosin-Kinasen wie den VEGFR und den platelet-derived growth factor receptor (PDGF).
Letzterer wird von Prostatakarzinomen und Metastasen aus kastrationsrefraktärem Prostatakrebs exprimiert.
Sunitinib wurde als Monotherapie bei Patienten mit kastrationsresistentem Prostatakrebs, die nach ein bis zwei zytotoxischen
Behandlungsregimen einschließlich Docetaxel progredient waren, in einer Phase-II-Studie geprüft [23]. Die
radiographische klinische Beurteilung ergab bei 36 Patienten ein medianes progressionsfreies Überleben von 19,4 Wochen. In
vier Fällen sank der PSA-Spiegel um mindestens 50% und in sieben Fällen um mindestens 30 %. Gemäß RECIST kam es bei zwei
von 18 Patienten mit messbarer Krankheit zu einem 30%igen Rückgang, und bei acht Patienten wurde eine geringgradige
Schrumpfung registriert.
Docetaxel plus Bevacizumab
Patienten mit progredientem kastrationsresistentem Prostatakrebs erhielten nach vorausgegangener Behandlung mit Docetaxel
als Second-line-Therapie die Kombination Bevacizumab (10 mg/kg) und Docetaxel (60 mg/m2) alle drei Wochen.
In elf Fällen (55%) wurde ein deutliches PSA-Ansprechen registriert. Bei vier dieser Männer war das zuvor unter Docetaxel
alleine nicht beobachtet worden [24].
-
In den letzten Jahren wurde intensiv auf dem Gebiet der Immuntherapie bei kastrationsresistentem Prostatakrebs geforscht.
Hierbei kam es zur Entwicklung des Impfstoffs Sipuleucel-T. Doch anders als bei präventiven Impfstoffen handelt es sich
bei Sipuleucel-T um eine so genannte therapeutische Vakzine. Das Präparat besteht aus autologen (körpereigenen)
dendritischen Zellen, die ex vivo mit dem Fusionsprotein PA2024 aus dem Enzym Prostata-spezifische saure Phosphatase
und dem humanen Granulozyten/Makrophagen Kolonie-stimulierenden Faktor (GM-CSF) inkubiert wurden.
Die zusammengefasste Analyse zweier sehr ähnlich konzipierter, randomisierter, Placebo-kontrollierter Phase-III-Studien ergab in der Studiengruppe eine 33%ige Reduktion des Mortalitätsrisikos mit einer mittleren Überlebenszeit von 23,2 Monaten bei Behandlung mit Sipuleucel-T und 18,9 Monaten in der Placebo-Gruppe [25].
Sipuleucel-T wurde in den USA für asymptomatische oder minimal symptomatische Patienten mit kastrationsresistentem
Prostatakrebs zugelassen. Gegenwärtig bleibt die Anwendung aber auf die etwa 50 Zentren, die an der Entwicklung der
Vakzine beteiligt waren, beschränkt. Die Produktionskapazität ist auf ca. 2.000 Patienten beschränkt.
Literatur:
[1] Di Lorenzo G, Buonerba C, Autorino R, et al. 2010. Castration-resistant prostate cancer. Current and emerging treatment strategies. Drugs 70:983-1000.
[2] Schrijvers D, van Erps P, Cortvriend J. 2010. Castration-refractory prostate cancer: new drugs in the pipeline. Adv Ther 27:285-296.
[3] Fizazi K, Sternberg CN, Fitzpatrick JM, et al. 2010. Role of targeted therapy in the treatment of advanced prostate cancer. BJU Int 105:748-767.
[4] Meulenbeld HJ, Hamberg P, de Witt R, 2009. Chemotherapy in patients with castration-resistent prostate cancer. Eur J Cancer 45 (Suppl 1): 161-171.
[5] Doehn C, Sommerauer M, Guo X, et al. 2009. Hormone Refractory Prostate Cancer: Focus on Sipuleucel-T. Clinical Medicine Therapeutics 2009:1 595-600.
[6] Mostaghel EA, Page ST, Lin DW, 2007. Intraprostatic androgens and androgen-regulated gene expression persist after testosterone suppression: therapeutic implications for castration-resistant prostate cancer. Cancer Res 67:5033-5041.
[7] Mostaghel EA, Nelson PS, 2008. Intracrine androgen metabolism in prostate cancer progression: mechanisms of castration resistance and therapeutic implications. Best Pract Res 22:243-58.
[8] Chun JY, Nadiminty N, Dutt S, et al. 2009. Interleukin-6 regulates androgen synthesis in prostate cancer cells. Clin Cancer Res 15:4815-4822.
[9] Scher HI, Beer TM, Higano CS, et al. 2010. Antitumour activity of MDV3100 in castration-resistant prostate cancer: a phase 1—2 study. Lancet 375:1437-1446.
[10] Jiang J, Huang H. 2010. Targeting the androgen receptor by taxol in castrations-resistant prostate cancer. Mol Cell Pharmacol 2:1-5.
[11] Gan L, Chen S, Wang Y, et al. 2009. Inhibition of the androgen receptor as a novel mechanism of taxol chemotherapy in prostate cancer. Cancer Res 69:8386-8394.
[12] James ND, Caty A, Borre M, et al. 2009. Safety and efficacy of the specific endothelin-A receptor antagonist ZD4054 in patients with hormone-resistant prostate cancer and bone metastases who were pain free or mildly symptomatic: a double-blind, placebo-controlled, randomised, phase 2 trial.Eur Urol.55:1112-1123.
[13] Tannock F, de Wit R, Berry WR, et al. 2004. Docetaxel plus prednisone or mitoxantone plus prednisone for advanced prostate cancer. N Engl J Med 351:1502-1512.
[14] Petrylak DP, Tangen CM, Hussain MH, et al. 2004. Docetaxel and estramustine compared with mitoxantrone and prednisone for advanced prostate cancer. N Engl J Med 351:1513-1520.
[15] Armstrong AJ, Tannock IF, de Wit R, et al. 2010. The development of risk groups in men with metastatic castration-resistant prostate cancer based on risk factors for PSA decline and survival. Eur J Cancer 46:517-525.
[16] Galsky MD, Vogelzang NJ, 2010. Docetaxel-based combination therapy for castration-resistant prostate cancer. Ann Oncol doi:10.1093/annonc/mdq050
[17] Nakagami Y, Ohori M, Sakamoto NH, et al. 2010. Safety and efficacy of docetaxel, estramustine phosphate and hydrocortisone in hormone-refractory cancer patients. Int J Urol 2010 Apr 26. [Epub ahead of print].
[18] Zurita AJ, Liu G, Hutson T, et al. 2009. Sunhitinib in combination with docetaxel and prednisone in patients (pts) with metastatic, hormone-refractory prostate cancer (mHRPC). J Clin Oncol 27(Suppl):275s (Abstr 5166).
[19] Sartor AO, Oudard S, Ozguroglu M, et al. 2010. Cabazitaxel or mitoxantrone with prednisone in patients with metastatic castration-resistant prostate cancer (mCRPC) previously treated with docetaxel: final results of a multinational phase III trial (TROPIC). J Clin Oncol 28(Suppl):7s (Abstr 4508).
[20] Eymard J-C, Oudard S, Gravis G, et al. 2010. Docetaxel reintroduction in ptients with metastatic castration-resistant docetaxel-sensitive prostate cancer: a retrospective multicentre study. BJU Int doi.10.1111/j.1454-410X.2010.09296.x
[21] Sternberg CN, Petrylak DP, Sartor O, et al. 2009. Multinational, double-blind, phase III study of prednisone and either satraplatin or placebo in patients with castrate-refractory prostate cancer progressing after prior chemotherapy: the SPARC trial. J Clin Oncol 27:5431-5438.
[22] Regan MM, O’Donnell EK, Kelly WK, et al. 2010. Efficacy of carboplatin–taxane combinations in the management of castration-resistant prostate cancer: a pooled analysis of seven prospective clinical trials. Ann Oncol 21:312-318.
[23] Sonpavde G, Periman PO, Bernold D, et al. 2010. Sunitinib malate for metastatic castration-resistant prostate cancer following docetaxel-based chemotherapy. Ann Oncol 21: 319–324.
[24] Di Lorenzo G, Figg WD, Fossa SD, et al. 2008. Combination of bevacizumab and docetaxel in docetaxel-pretreated hormone-refractory prostate cancer: a phase 2 study. Eur Urol 54:1089-1094.
[25] Higano CS, Schellhammer PF, Small EJ, et al. 2009. Integrated data from 2 randomized, double-blind, placebo-controlled phase 3 trials of active cellular immunotherapy with sipuleucel-T in advanced prostate cancer. Cancer 115:3670-3679.
© 2003-2025 pro-anima medizin medien
–
impressum
–
mediadaten
–
konzeption
–
datenschutz
