
Beim RCC wird nach aktuellen Gesichts-
Tumorbiologie, prognostische Modelle und prädiktive Faktoren
Das Verständnis der Tumorbiologie des Nierenzellkarzinoms (RCC) hat in den letzten beiden Jahrzehnten einen gewaltigen Sprung nach vorne getan. Im Zentrum dieser Entwicklung stehen die Aufklärung der Tumorangiogenese über die Signalkaskade des vaskulären endothelialen Wachstumsfaktors (VEGF) und der Regulierung des Zellwachstums über den mammalian target of rapamycin (mTOR)-Reaktionsweg. Das führte zur Entwicklung zielgerichteter Medikamente, die spezifisch molekulare Mechanismen der Tumorgenese inhibieren. Mit diesen Therapien konnte in jüngster Vergangenheit eine signifikante Verlängerung der Überlebenszeit der Patienten mit metastasiertem RCC erreicht werden. Wesentlich ist zudem, dass die zielgerichteten Substanzen gegenüber den Zytokintherapien – insbesondere dem hoch dosierten IL-2 –, die zuvor im Fokus der Therapie des metastasierten RCC gestanden hatten, ein eher zu tolerierendes Toxizitätsprofil aufweisen.
Möglichst präzise prognostische Aussagen hinsichtlich des individuellen natürlichen Krankheitsverlaufs
sind einerseits für die fundierte Beratung der RCC-Patienten und andererseits für die Auswahl der jeweils
geeignetsten Therapie von großer Wichtigkeit. Hierfür stehen eine Reihe prognostischer Modelle zur Auswahl,
deren Anwendbarkeit auf unterschiedliche Stadien der Krankheit wie insbesondere nicht metastasiert und
metastasiert abgestimmt sind. In diesem Zusammenhang wird auch weiterhin intensiv nach prädiktiven Biomarkern
geforscht, die bei der Frage ‘in welcher klinischen Situation welche zielgerichtete Therapie die am besten
geeignete ist’, als Entscheidungshilfe dienen können (neuere Reviews [1-3].
Histologische Typen des Nierenzellkarzinoms
-
Ehemals wurde Nierenkrebs als einheitliche maligne Krankheit betrachtet. Allerdings wird beim RCC
nach aktuellen Gesichtspunkten zwischen einer Reihe von Subtypen mit zum Teil unterschiedlicher
molekularbiologischer Karzinogenese unterschieden. Für die Risikobewertung eines RCC spielt auch
der histologische Typ eine wichtige Rolle.
Klarzelliges Nierenzellkarzinom
Mit 75 bis 80% ist das klarzellige RCC der mit Abstand häufigste Nierenkrebs, der histogenetisch
dem proximalen Tubulusepithel entstammt. Zumeist findet sich ein kompaktes Wachstumsmuster, doch
es kommen auch tubulopapilläre oder zystische Formen vor. Infolge des enorm hohen Glykogengehalts
weist das klarzellige RCC mikroskopisch ein optisch leer erscheinendes Zytoplasma auf
(Abb. 1). Eosinophile Varianten lassen sich auf einen vermehrten Gehalt an
Mitochondrien und endoplasmatischem Retikulum zurückführen.
Bei bis zu ca. 80% der sporadischen klarzelligen RCC wurden Mutationen des von
Hippel-
Die papillären RCC vom Typ II sind allgemein schlechter differenziert als die vom Typ I. Demzufolge
neigen sie auch eher zur Metastasierung. Histopathologisch finden sich auf tubopapillären Kernen
größere Zellen mit eosinophilem Zytoplasma.
Chromophobes Nierenzellkarzinom
Das chromophobe Nierenzellkarzinom macht bis etwa 5% aller Nierenzellkarzinom-Fälle aus. Der
Subtyp stammt von den Epithelzellen des distalen Tubulus ab. Bei weniger weit fortgeschrittenem
Stadium zum Zeitpunkt der Resektion ist die Krankheit mit einer guten Langzeitprognose behaftet
(Abb. 3).
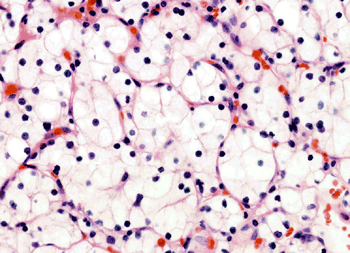
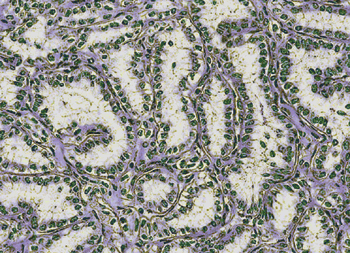
Abb. 1: Klarzelliges RCC: Reichhaltiges Glykogen und Fette im Zytoplasma verleihen
den Zellen auf Paraffinschnitten im Mikroskop ein leeres Aussehen.
Abb. 2: Papilläres RCC Typ 1: Das papilläre Muster besteht aus Zellen mit
hellem Zytoplasma und apikal gelegenen Zellkernen.
Papilläres Nierenzellkarzinom
Papilläre Nierenzellkarzinome machen etwa 15% bis 20% der malignen Nierentumore aus. Histologisch
wird insbesondere zwischen den Subtypen I und II unterschieden. Andererseits liegen öfters auch
Mischformen vor, oder es lassen sich keine deutlichen Merkmale eines der beiden Subtypen erkennen.
Beim Typ I entwickeln sich häufig bilateral multifokale, hypovaskularisierte Tumore mit relativ
geringerer Metastasierungstendenz. Die kleinen, basophilen Zellen sind papillär oder tubulär
angeordnet (Abb. 2). In den meisten Fällen handelt es sich um sporadisch auftretende
Tumoren, die dennoch nicht selten Mutationen oder Amplifikationen des Proto-
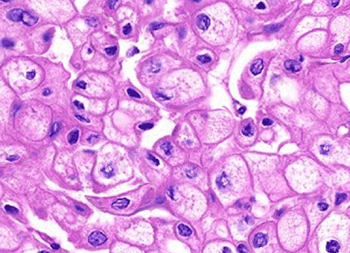
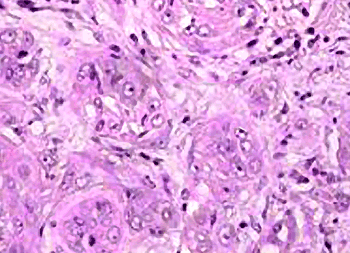
Abb. 3: Chromophobes RCC: Der chromophobe Zelltyp ist durch große
polygonale Zellen
mit leicht retikuliertem Zytoplasma gekennzeichnet.
Abb. 4: Ductus-Bellini-Karzinom: Proliferierende Duktuszellen liegen im entzündeten
desmoplastischen Stroma.
Ductus-Bellini-Karzinom
Das Ductus-Bellini-Karzinom (Sammelrohrkarzinom) ist ein seltenes (~1%), äußerst aggressives
Nierenkarzinom. Histologisch treten papilläre, tubuläre und mikrozystische Gewebsmuster auf.
Das Stroma imponiert durch die ausgeprägte desmoplastische Reaktion (Abb. 4).
Die histologischen Merkmale ähneln denen des Urothelkarzinoms. Ein gemeinsames Auftreten von
Ductus-
-
Die Mehrheit der Nierenkarzinome ist sporadisch. Andererseits verdoppelt sich das Risiko, an Nierenkrebs
zu erkranken, sofern ein Verwandter ersten Grades betroffen ist. So stehen ungefähr 4% der Nierenkarzinome
im Zusammenhang mit hereditären Krebssyndromen. Es gibt insbesondere vier beschriebene Typen des erblichen
epithelialen Nierenkarzinoms: Von Hippel-
Von Hippel-Lindau-Syndrom
EGF(R)= endothelialer Wachstumsfaktor(rezeptor), IGF-1(R) = insulinähnlicher
Wachstumsfaktor-1(Rezeptor), mTOR = mammalian target of rapamycin,
MAPK = Mitogen-aktivierte Proteinkinase, PI3K = Phospho
Hereditäre Leiomyomatose/RCC
Birt-Hogg-Dubé-Syndrom
Das an der University of California in Los Angeles (UCLA) entwickelte Integrated Staging
System (UISS) dient der Abschätzung der Überlebenserwartung nach erfolgter Nephrektomie bei
Patienten mit RCC aller Stadien [9]. In das Modell sind das TNM-Stadium,
der Fuhrman-
An der Mayo Klinik (Rechester, Minn.) wurde ein prädiktives Modell für nephrektomierte Patienten
mit klarzelligem RCC auf der Basis des TNM-Stadiums, der Tumorgröße, des Differenzierungsgrades
und Nekrotisierung entwickelt: SSIGN Score [11]. Die verfügbaren klinischen und pathologischen
Merkmale sind multivariat signifikant mit dem krebsspezifischen Überleben assoziiert. Zur
Validierungen des SSIGN Score wurde in Europa eine unabhängige Auswahl an Patienten (n=388) mit
klarzelligem RCC, die sich einer radikalen oder partiellen Nephrektomie unterzogen hatten,
retrospektiv herangezogen. Dem einfachen Algorithmus wurde ein hoher Grad an prognostischer
Genauigkeit attestiert [12]. Das bestätigte sich im Wesentlichen bei einer Validierung anhand
routinemäßiger Pathologieberichte [13].
In einer genomischen Untersuchung wurde archiviertes, Paraffin-eingebettetes Gewebematerial
von 931 nephrektomierten Patienten mit klarzelligem RCC (Stadium I-III) daraufhin untersucht,
ob die Genexpression im Tumor postoperativ die Prognose beeinflusst. Anhand eines multivariaten
Modells wurden 16 Gene identifiziert, die hoch signifikant mit dem rezidivfreien Intervall im
Zusammenhang stehen. Hierunter waren Gene, die in die Angiogenese, das Immunansprechen, die
Zelladhäsion und die Steuerung des Zellzyklus involviert sind [14].
Bei 1.707 Patienten mit lokalisiertem, unilateralem, sporadischem, klarzelligem RCC wurde
ermittelt, inwieweit präoperative Laborparameter unabhängig mit krebsspezifischem Tod nach
radikaler Nephrektomie im Zusammenhang stehen. Anormale präoperative Werte einschließlich
Hyperkalzämie, Anämie und Erythrozytensedimentationsrate wiesen nach multivariater Korrektur
unabhängig auf das erhöhte Risiko hin, am Nierenkrebs zu versterben [15].
Die Etablierung der Motzer-
In das klinisch prognostische Modell des International Metastatic RCC Database Consortium gingen
vier der fünf negativen prognostischen Faktoren des MSKCC-Modells ein, die zugleich als unabhängige
Prädiktoren einer verkürzten Überlebensdauer gelten: (1) Hämoglobinkonzentration unterhalb des
Normwertes, (2) korrigierte Kalziumkonzentration oberhalb des Normbereichs, (3) Karnofsky
Performance Score unter 80 und (4) Zeitspanne von der Nierenkrebsdiagnose bis zum Beginn der
systemischen Therapie bei fortgeschrittener Krankheit unterhalb eines Jahres. Zusätzlich werden
in dem Modell die Zahl der neutrophilen Granulozyten und die Thrombozytenzahl unterhalb des
Normbereichs als unabhängige negative prognostische Faktoren berücksichtigt
(Tabelle) [19].
Von Hippel-Lindau-Gen
Phosphatase and Tensin Homolog (PTEN) PTEN ist ein Tumorsuppressorprotein, durch das proliferierende
Effekte des Phosphoinositid-3-
In einer immunhistochemischen Analyse der PTEN-Expression in Gewebeproben verschiedener RCC-Subtypen
wurde im Tumorgewebe ein geringerer PTEN-Gehalt ermittelt als im normalen Nierengewebe. Diese
Erniedrigung war in Tumoren mit niedriger T-Klassifikation (T1/2) und bei lokalisierter Krankheit
signifikant am geringsten ausgeprägt. Zudem wurde ermittelt dass die PTEN-Expression in klarzelligen
RCC am niedrigsten ist. Das kann als Indiz gewertet werden, dass der mTOR-Reaktionsweg in die
Pathogenese dieses RCC-Subtyps insbesondere deutlich involviert ist. Die vermehrte Expression des
Proteins PTEN stand im Zusammenhang mit verlängertem Gesamtüberleben. Es wird geschlossen, dass
Patienten mit metastasiertem klarzelligem RCC und sehr niedriger PTEN-Expression wahrscheinlich
von der Therapie mit einem mTOR-Inhibitor profitieren können [22].
Vaskulärer endothelialer Wachstumsfaktor
Bei Patienten mit Bevacizumab-refraktärem, metastasiertem RCC wurde eine beträchtliche antitumoröse
Aktivität von Sunitinib festgestellt. Das unterstützt die Hypothese, wonach der Tyrosinkinase-
Carbonanhydrase 9 (CAIX)
Das klinische Ansprechen des RCC auf eine IL-2-Therapie wurde mit der CAIX-Expression in Zusammenhang
gebracht. Eine solche Abhängigkeit sollte sich auch hinsichtlich des Krankheitsergebnisses
bemerkbar machen. Diesbezügliche wurde eine Überprüfung an pathologischen Gewebeproben von
RCC-Patienten, die zuvor eine IL-2-Therapie erhalten hatten, vorgenommen. Dabei ließ sich eine
längere Überlebensdauer bzw. ein mehr als fünfjähriges Überleben nur bei Patienten mit hoher
CAIX-Expression feststellen [27].
Daraufhin wurde geprüft, inwieweit die CAIX-Expression auch bei Patienten, die mit einer
gegen den VEGF-Signalweg gerichteten Therapie behandelt werden, prognostisch und prädiktiv
anwendbar ist. In der Studie mit 118 Patienten bestand je nach CAIX-Status ein heterogenes
Tumoransprechen auf Sunitinib und Sorafenib. Die Höhe der CAIX-Expression hatte bei
den mit VEGF-Target-
Hypoxie-induzierbarer Faktor-alpha
In archivierten Nephrektomie-Gewebeproben von Patienten mit metastasiertem klarzelligem
RCC wurde der Expressionsspiegel von HIF-1α und HIF-2α mittel Immunoblot-
Ki-67
Das von Hippel-Lindau-Syndrom ist neben dem hohen Risiko für verschiedene Krebsentitäten wie
Hämangioblastome des ZNS, Retina-Angiome und Phäochromozytome auch mit dem für solide Tumoren wie
dem klarzelligen Nierenzellkarzinom verbunden. Die Vererbung der Tumorsuppressor-
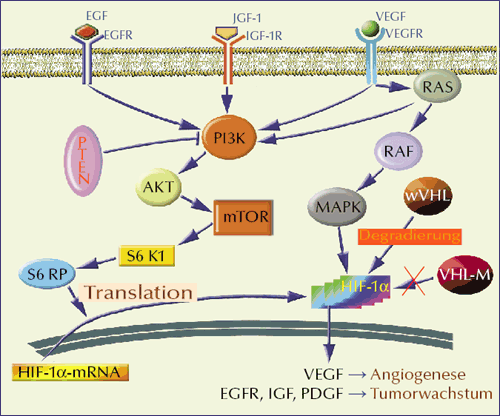
Abb. 5: Signalkaskaden der Tumorbiologie und Tumorgenese des klarzelligen
Nierenzellkarzinoms: Die stark vereinfachte Darstellung stellt angiogene Reaktionswege in
den Vordergrund. Bei inaktivem von Hippel-
Hereditäres papilläres Nierenzellkarzinom
Das hereditäre papilläre Nierenzellkarzinom (HPRCC) wird autosomal dominant mit unvollständiger
Penetranz vererbt. Es beruht auf einer Keimlinienmutation des Proto-Onkogens MET und ist einheitlich
vom papillären Typ I.
Die papillären Nierenkarzinome vom Typ II sind sehr aggressiv und können bei bis zu 25% der Patienten
mit hereditärer Leiomyomatose/RCC auftreten. Sie finden sich dann zumeist unilateral und sind solitär.
Hereditäre Leiomyomatose/RCC ist ein durch Mutationen im Fumarat-Hydratase Gen (FH) verursachtes,
erbliches Tumorsyndrom mit autosomal-dominanter Vererbung [6]. Charakteristischerweise treten bei
dem Gendefekt Nierenkrebs und/oder Glattmuskel-Tumoren der Haut und des Uterus auf.
Das Birt-Hogg-Dubé-Syndrom ist eine erbliche Krankheit, bei der es neben vorwiegend kutanen Manifestationen
selten auch zur Entstehung von Nierenkarzinomen kommen kann. Von 130 resektierten Nierentumoren bei
30 Patienten mit dem Birt-
Risikoprofile für Patienten mit RCC vor und nach Nephrektomie
Bei Patienten mit RCC kann sich das Krankheitsergebnis auch bei Tumoren mit ähnlicher Morphologie
und gleichem Stadium deutlich unterscheiden. Daraus entsteht das Bedürfnis, mit prognostischen
Profilen den natürlichen Krankheitsverlauf von RCC individuell einschätzen zu können.
Prognose-Modelle für das fortgeschrittene/metastasierte RCC
In der metastasierten Situation geht die prognostische Bedeutung der anatomischen und
histologischen Merkmale des Primärtumors weitgehend verloren. Sie werden durch eine Reihe
von Faktoren im Zusammenhang mit der Konstitution des Patienten und krankheitsbezogener
Charakteristika ersetzt (Tabelle). Eines der am häufigsten angewendeten prognostischen Modelle
ist das Memorial Sloan-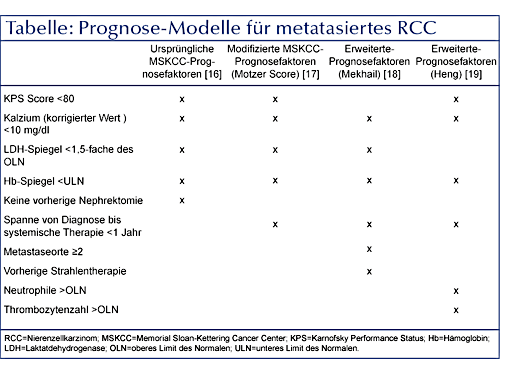 In einer Erweiterung des Motzer-Score nach externer Validierung – den so genannten
Mekhail-
In einer Erweiterung des Motzer-Score nach externer Validierung – den so genannten
Mekhail-
Prädiktive Biomarker des fortgeschrittenen RCC
Nach prädiktiven Biomarkern für das fortgeschrittene/metastasierte RCC wird seit längerer Zeit
intensiv geforscht. Doch trotz beträchtlichen Datenmaterials mit Ansätzen zur Identifizierung
individualisierter Behandlungsoptionen, werden Biomarker in der klinischen Praxis bislang nicht
routinemäßig prädiktiv herangezogen.
Die Inaktivierung des VHL-Gens ist ein entscheidender Faktor der klarzelligen RCC-Pathogenese,
so dass die Art der Inaktivierung mit dem Ansprechen auf antiangiogene Therapien im Zusammenhang
stehen könnte. In einer diesbezüglichen Untersuchung mit 123 Patienten betrug die Ansprechrate
bei VHL-Inaktivierung 41% gegenüber 31% bei Vorliegen des VHL-Wildtyps (p=0,34). Bei Patienten
mit Funktionsverlustmutationen (Frameshift-
Bei 50 Patienten mit RCC wurde gezeigt, dass sowohl die zytoplasmatische VEGF-Expression als
auch der Plasma-
Das transmembrane Protein CAIX wird im normalen Nierengewebe nur in geringem Ausmaß exprimiert.
Hingegen ist das Enzym in Klarzell-RCC mit VHL-Mutation deutlich überexprimiert. Erniedrigte Spiegel
an CAIX stehen bei fortgeschrittenem RCC unabhängig im Zusammenhang mit schlechten
Überlebensaussichten [26].
Die Expression von HIF-1alpha kann bei Patienten mit klarzelligem RCC als unabhängiger
prognostischer Faktor herangezogen werden. Bei Immunfärbungen des HIF-1alpha, die mehr
als 35% des Präparats umfassten, war die Überlebensdauer der Patienten kürzer als bei
geringerer Immunfärbung [30].
Die immunhistochemische Färbung des Proliferationsmarkers Ki-67 ist eine verbreitet
genutzte pathologische Routinediagnostik. Beim klarzelligen RCC gilt der immunhistochemische
Nachweis von Ki-67 als prognostischer Indikator biologischer Aggressivität. In einer Studie
an klarzelligen RCC unterschiedlicher Stadien mit unterschiedlichen Differenzierungsgraden
waren der Ki-67-Index und Metastasen signifikante unabhängige Prognosefaktoren [32].
Prof. Dr. Dr. J.F. Schindler, Mülheim
Literatur:
[1] Sun M, Shariat SF, Cheng C, et al. 2011).
Prognostic factors and predictive models in renal cell carcinoma: a contemporary review. Eur Urol 60:644-661.
[2] Finley DS, Pantuck AJ, Belldegrun AS, 2011.
Tumor biology and prognostic factors in renal cell carcinoma. Oncologist 16 (suppl 2):4-13.
[3] Eisengart LJ, MacVicar GR, Yang XJ, 2012.
Predictors of response to targeted therapy in renal cell carcinoma. Arch Pathol Lab Med 136:490-495.
[4] Orsola A, Trias I, Raventós CX, et al. 2005.
Renal collecting (Bellini) duct carcinoma displays similar characteristics to upper tract urothelial
cell carcinoma. Urology 65:49-54.
[5] Pfaffenroth EC, Linehan WM, 2008.
Genetic basis for kidney cancer. Opportunity for disease-specific approaches to therapy.
Expert Opin Biol Ther 8:779-790.
[6] Toro JR, Nickerson ML, Wei MH, et al. 2003.
Mutations in the fumarate hydratase gene cause hereditary leiomyomatosis and renal cell
cancer in families in North America. Am J Hum Genet 73:95-106.
[7] Pavlovich CP, Walther MM, Eyler RA, et al. 2002.
Renal tumors in the Birt-Hogg-Dubé syndrome. Am J Surg Pathol 26:1542-1552.
[8] Hes O, Petersson F, Kuroda N, et al. 2013.
Renal hybrid oncocytic/chromophobe tumors - a review. Histol Histopathol 28:1257-1264.
[9] Zisman A, Pantuck AJ, Dorey F, et al. 2001.
Improved prognostication of renal cell carcinoma using an integrated staging system.
J Clin Oncol 19:1649-1657.
[10] Cindolo L, Chiodini P, Gallo C, et al. 2008.
Validation by calibration of the UCLA integrated staging system prognostic model for
nonmetastatic renal cell carcinoma after nephrectomy. Cancer 113:65-71.
[11] Frank I, Blute ML, Cheville JC, et al. 2002.
An outcome prediction model for patients with clear cell renal cell carcinoma treated
with radical nephrectomy based on tumour stage, size, grade and necrosis: the SSIGN score.
J Urol 168:2395-2400.
[12] Ficarra V, Martignoni G, Lohse C, et al. 2006.
External validation of the Mayo Clinic Stage, Size, Grade and Necrosis (SSIGN) score to
predict cancer specific survival using a European series of conventional renal cell carcinoma.
J Urol 175:1235-1239.
[13] Zigeuner R, Hutterer G, Chromecki T, et al. 2010.
External validation of the Mayo Clinic stage, size, grade, and necrosis (SSIGN) score for
clear-cell renal cell carcinoma in a single European centre applying routine pathology. Eur Urol 57:102-109.
[14] Rini BI, Zhou M, Aydin H, et al. 2010.
Identification of prognostic genomic markers in patients with localized clear cell renal
cell carcinoma (ccRCC). J Clin Oncol 28:15s (suppl; abstr 4501).
[15] Magera Jr JS, Leibovich BC, Lohse CM, et al. 2008.
Association of abnormal preoperative laboratory values with survival after radical nephrectomy
for clinically confined clear cell renal cell carcinoma. Urology 71:278-282.
[16] Motzer RJ, Mazumdar M, Bacik J, et al. 1999.
Survival and prognostic stratification of 670 patients with advanced renal cell carcinoma.
J Clin Oncol 17:2530-2540.
[17] Motzer RJ, Bacik J, Murphy BA, et al. 2002.
Interferon-alfa as a comparative treatment for clinical trials of new therapies against advanced
renal cell carcinoma. J Clin Oncol 20:289-296.
[18] Mekhail TM, Abou-Jawde RM, BouMerhi G, et al. 2005.
Validation and extension of the Memorial Sloan-Kettering prognostic factors model for survival
in patients with previously untreated metastatic renal cell carcinoma. J Clin Oncol 23:832-841.
[19] Heng DYC, Xie W, Regan MM, et al. 2009.
Prognostic factors for overall
survival in patients with metastatic renal cell carcinoma treated with vascular endothelial
growth factor-targeted agents: results from a large, multicenter study. J Clin Oncol 27:5794-5799.
[20] Choueiri TK, Vaziri SA, Jaeger E, et al. 2008.
von Hippel-Lindau gene status and response to vascular endothelial growth factor
targeted therapy for metastatic clear cell renal cell carcinoma. J Urol 180:860-865.
[21] Neshat MS, Mellinghoff IK, Tran C, et al. 2001.
Enhanced sensitivity of PTEN-deficient tumors to inhibition of FRAP/mTOR.
Proc Natl Acad Sci USA 98:10314-10319.
[22] Tsavachidou-Fenner D, Tannir N, Tamboli P, et al. 2010.
Gene and protein expression markers of response to combined antiangiogenic and epidermal
growth factor targeted therapy in renal cell carcinoma. Ann Oncol 21:1599-1606.
[23] Rioux-Leclercq N, Fergelot P, Zerrouki S, et al. 2007.
Plasma level and tissue expression of vascular endothelial growth factor in renal cell
carcinoma: a prospective study of 50 cases. Hum Pathol 38:1489-1495.
[24] Klatte T, Böhm M, Nelius T, et al. 2007.
Evaluation of peri-operative peripheral and renal venous levels of pro- and anti-angiogenic
factors and their relevance in patients with renal cell carcinoma. BJU Int 100:209–214.
[25] Rini BI, Michaelson MD, Rosenberg JE, et al. 2008.
Antitumor activity and biomarker analysis of sunitinib in patients with bevacizumab-refractory
metastatic renal cell carcinoma. J Clin Oncol 26:3743-3748.
[26] Bui MHT, Seligson D, Han K-R, et al. 2003.
Carbonic anhydrase IX is an independent predictor of survival in advanced renal
clear cell carcinoma: implications for prognosis and therapy. Clin Cancer Res 9:802-811.
[27] Atkins M, Regan M, McDermott D, et al. 2005.
Carbonic anhydrase IX expression predicts outcome of interleukin 2 therapy for
renal cancer. Clin Cancer Res 11:3714-3721.
[28] Choueiri TK, Regan MM, Rosenberg JE, et al. 2010.
Carbonic anhydrase IX and pathological features as predictors of outcome in patients with
metastatic clear-cell renal cell carcinoma receiving vascular endothelial growth factor-targeted
therapy. BJU Int 106:772-778.
[29] Choueiri TK, Cheng S, Qu AQ, et al. 2013.
Carbonic anhydrase IX as a potential biomarker of efficacy in metastatic clear-cell renal
cell carcinoma patients receiving sorafenib or placebo: Analysis from the treatment approaches
in renal cancer global evaluation trial (TARGET). Urol Oncol-Semin Ori 31:1788-1793.
[30] Klatte T, Seligson DB, Riggs SB, et al. 2007.
Hypoxia-inducible factor 1alpha in clear cell renal cell carcinoma. Clin Cancer Res 13:7388–7393.
[31] Patel P, Chadalavada R, Ishill N, et al. 2008.
Hypoxia-inducible factor (HIF) 1 and 2 levels in cell lines and human tumor predicts response
to sunitinib in renal cell carcinoma (RCC). J Clin Oncol 26 (Suppl):[abstr 5008].
[32] Rioux-Leclercq N, Turlina B, Bansard J-Y, et al. 2000.
Value of immunohistochemical Ki-67 and p53 determinations as predictive factors of
outcome in renal cell carcinoma. Urology 55:501-505.
© 2003-2025 pro-anima medizin medien
–
impressum
–
mediadaten
–
konzeption
–
datenschutz
