kurzgefasst: prostatakrebs — hodenkrebs — blasenkrebs — nierenkrebs — peniskrebs — urologische Themen
Rezidivierende Keimzelltumoren:
Irinotecan, Paclitaxel und Oxaliplatin als Alternative zur Cisplatin-basierten Chemotherapie
Die Wirksamkeit der Irinotecan, Paclitaxel und Oxaliplatin (IPO)-Chemotherapie war bei Patienten mit rezidivierten Keimzelltumoren nach zwei Cisplatin-basierten Regimen bereits in einer Phase-II-Studie nachgewiesen worden. Aktuell werden die fortgeschriebenen Daten eines britischen Kliniknetzes mit adaptierten Protokoll vorgestellt, dass auch Patienten älter als 35 Jahre und erhöhtem Spiegel an Laktatdehydrogenase einschließt.
Aufeinander folgende 72 Patienten hatten IPO als Zweit- (n=29) oder Drittlinientherapie (n=43) erhalten. Bei 20 der ersteren und 32 der letzteren Fälle war zur Konsolidierung der IPO danach zu einer Hochdosis-Chemotherapie (HCT) mit Topotecan, Carboplatin und Thiotepa übergegangen worden.
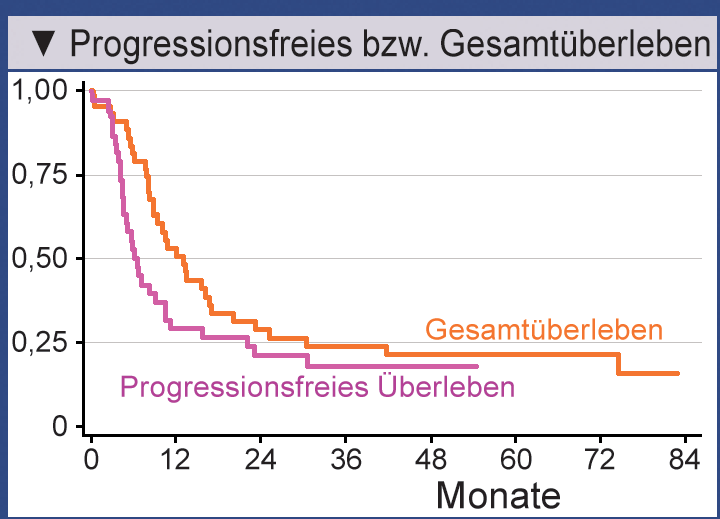
Nach dem ersten Rezidiv hatten sechs Patienten ein komplettes Ansprechen, vier keinen Nachweis
der Krankheit nach der Operation und bei neun Männern hatten sich die Tumormarker normalisiert – ohne
Auftreten neuer Krankheitsorte für 28 Tage. Von den Patienten, die nach dem ersten Rezidiv IPO
bzw. IPO + HCT erhalten hatten, waren nach zwei Jahren 43,5% progressionfrei. Die Rate an
Gesamtüberleben betrug nach drei Jahren 49,1%. Bei der Drittlinienbehandlung mit IPO
bzw. IPO + HCT wurde ein zufriedenstellendes Ansprechen erzielt. Die Progressionsfreiheit
nach zwei Jahren und das Gesamtüberleben nach drei Jahren betrugen 21,0% bzw. 23,9% (Abb.).
Badreldin W, Krell J, Chowdhury S, et al. 2016. The efficacy of irinotecan, paclitaxel, and oxaliplatin (IPO) in relapsed germ cell tumours with high-dose chemotherapy as consolidation: a non-cisplatin-based induction approach. BJU Int 117:418-423.
April 2016 red. drucken
drucken
Irinotecan, Paclitaxel und Oxaliplatin als Alternative zur Cisplatin-basierten Chemotherapie
Die Wirksamkeit der Irinotecan, Paclitaxel und Oxaliplatin (IPO)-Chemotherapie war bei Patienten mit rezidivierten Keimzelltumoren nach zwei Cisplatin-basierten Regimen bereits in einer Phase-II-Studie nachgewiesen worden. Aktuell werden die fortgeschriebenen Daten eines britischen Kliniknetzes mit adaptierten Protokoll vorgestellt, dass auch Patienten älter als 35 Jahre und erhöhtem Spiegel an Laktatdehydrogenase einschließt.
Aufeinander folgende 72 Patienten hatten IPO als Zweit- (n=29) oder Drittlinientherapie (n=43) erhalten. Bei 20 der ersteren und 32 der letzteren Fälle war zur Konsolidierung der IPO danach zu einer Hochdosis-Chemotherapie (HCT) mit Topotecan, Carboplatin und Thiotepa übergegangen worden.

Im Zusammenhang mit der Behandlung starben zwei Männer an IPO und vier an der HCT. Die Toxizität
Grad 3 oder 4 umfasste Neutropenie (35%), Thrombozytopenie (18%), Infektion (15%), Diarrhoe (11%) und Lethargie (8%).
Bei Patienten mit rezidivierten Keimzelltumoren bietet IPO eine effektive, gut verträgliche,
nicht nephrotoxische Alternative zur Cisplatin-basierten Salvage-Chemotherapie. Sie ist insbesondere
für Patienten sinnvoll, bei denen Cisplatin nicht effektiv oder kontraindiziert ist.
Badreldin W, Krell J, Chowdhury S, et al. 2016. The efficacy of irinotecan, paclitaxel, and oxaliplatin (IPO) in relapsed germ cell tumours with high-dose chemotherapy as consolidation: a non-cisplatin-based induction approach. BJU Int 117:418-423.
April 2016 red.
Warning: include(../../cols3/aa_kurz.php): failed to open stream: No such file or directory in /var/www/web383/html/uros/kurzgefasst/hodenkrebs/b_IPO.php on line 99
Warning: include(../../cols3/aa_kurz.php): failed to open stream: No such file or directory in /var/www/web383/html/uros/kurzgefasst/hodenkrebs/b_IPO.php on line 99
Warning: include(): Failed opening '../../cols3/aa_kurz.php' for inclusion (include_path='.:/opt/php/5.4.45/share/pear:/usr/share/pear') in /var/www/web383/html/uros/kurzgefasst/hodenkrebs/b_IPO.php on line 99
© 2003-2025 pro-anima medizin medien
–
impressum
–
mediadaten
–
konzeption
–
datenschutz