Im Januar 2017 hat die EU-Kommission die Zulassung von Votubia® Tabletten zur Herstellung einer Suspension zum Einnehmen (Everolimus) erweitert. Damit zählt zu den Anwendungsmöglichkeiten nun auch die Begleittherapie bei Patienten ab 2 Jahren mit refraktären partiellen Krampfanfällen, mit oder ohne sekundäre Generalisierung, die in Zusammenhang mit einer Tuberösen Sklerose (TSC) stehen [1]. Auf einer Pressekonferenz** erläuterten Experten die Bedeutung dieser Indikationserweiterung für Patienten und Ärzte und stellten die Ergebnisse der Zulassungsstudie EXIST-3 vor [2]. Danach reduzierte eine Begleittherapie mit Everolimus TSC-assoziierte, partielle epileptische Anfälle im Vergleich zu Placebo signifikant.
Tuberöse Sklerose (TSC) ist eine seltene Systemerkrankung, von der weltweit bis zu eine
Million Menschen betroffen sind [4]. Wie Dr. Adelheid Wiemer-Kruel vom Epilepsie- und TSC-Zentrum
Kork erläuterte, wird hierbei aufgrund eines genetischen Defekts der intrazelluläre mTOR-Signalweg
nicht mehr gehemmt, was zu Fehlbildungen und der Entstehung benigner Tumoren (Hamartome) in fast
allen Organen führen kann [5]. Eine schwere Komplikation der TSC ist das Auftreten einer Epilepsie,
das in der Regel mit der Entwicklung glioneuronaler Hamartome in der Hirnrinde (kortikale Tubera)
assoziiert ist [6]. Hiervon betroffen sind 80–90% der Patienten, wobei die Krampfanfälle meist
bereits in den ersten Lebensjahren auftreten [7]. Der Expertin zufolge zieht eine unbehandelte
TSC-assoziierte Epilepsie häufig eine Verzögerung der geistigen Entwicklung nach sich, was
für die Kinder und ihre Familien mit einem hohen Leidensdruck verbunden sein kann. Etwa
die Hälfte der Kinder weist geistige Behinderungen und Verhaltensauffälligkeiten wie
Autismus oder kognitive Beeinträchtigungen auf [8,9]. Ursache hierfür ist, dass mit den
bisher eingesetzten Therapieoptionen wie Antiepileptika, Neurochirurgie, Vagusnervstimulation
und ketogener Diät bei bis zu 60% der Betroffenen keine Anfallsfreiheit erreicht werden
kann [10]. „Umso wichtiger ist es, mit Everolimus eine neue wirksame Therapie zur Verfügung
zu haben, die hier doch noch einmal eine deutliche Verbesserung ermöglichen könnte“,
erläuterte Wiemer-Kruel. Zulassungsstudie belegt Wirksamkeit von Everolimus bei TSC-assoziierter Epilepsie
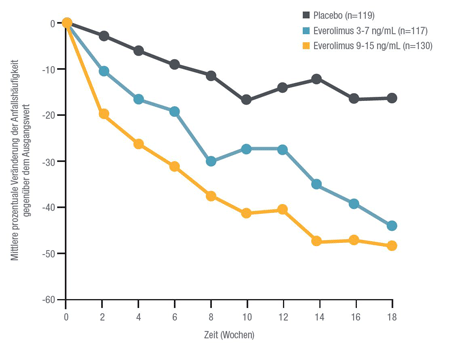
Basis der EU-Zulassung bei TSC-assoziierter Epilepsie waren die Ergebnisse der
Phase-III-Zulassungsstudie EXIST-3, die zeigte, dass Everolimus als Begleittherapie
zu Antiepileptika partielle epileptische Anfälle im Vergleich zu Placebo signifikant
reduzierte [2]. Wie Dr. Tilman Polster, Epilepsiezentrum Bielefeld, erläuterte, nahmen an
der Studie 366 TSC-Patienten mit therapierefraktärer Epilepsie teil, die in drei Gruppen
randomisiert wurden und entweder Placebo oder Everolimus in niedriger (3–7ng/ml, LEG) bzw.
hoher Exposition (9–15 ng/ml, HEH) erhielten. Zusätzlich wurden die Patienten in allen
Behandlungsarmen mit ein bis drei Anti-Epileptika (AEDsI) behandelt. Im primären Endpunkt,
der Reduktion der Anfallshäufigkeit um ≥50 % im Vergleich zum Ausgangswert, war Everolimus
in beiden Armen der Gabe von Placebo signifikant überlegen (LE: 28,2, 95-%-Konfidenzintervall (KI):
20,3–37,3; p=0,008; HE: 40,0%, 95-%-KI 31,5–49,0; p<0,0001; Placebo: 15,1%, 95-%-KI 9,2–22,8).
Gleiches galt für die mediane prozentuale Abnahme der Häufigkeit epileptischer Anfälle
gegenüber dem Ausgangswert (LE: 29,3%, 95-%-KI: 18,8–41,9; p=0,003; HE: 39,6%, 95-%-KI: 35,0–48,7;
p<0,0001; Placebo: 14,9%, 95-%-KI 0,1–21,7). Zu den häufigsten unerwünschten Ereignissen aller
Grade (≥15%) zählten in den beiden Verum-Armen Stomatitis, Diarrhoe, Fieber,
Nasopharyngitis und Infektionen der oberen Atemwege [2]. „Mit Everolimus steht uns ab
sofort ein sehr effizienter Wirkstoff zur Verfügung, der in Kombination mit Antiepileptika
die Häufigkeit TSC-assoziierter epileptischer Anfälle deutlich reduzieren und so dazu beitragen
kann, die schwerwiegenden Folgen dieser Erkrankung zu lindern oder ganz zu verhindern“, fasste
Polster zusammen. Beispiele zum praktischen Einsatz untermauern Bedeutung der neuen Therapieoption
Dieser Folgerung schloss sich auch Dr. Christoph Hertzberg, TSC-Zentrum Berlin, an, der
über eigene Erfahrungen beim Einsatz von Everolimus in dieser Indikation berichtete. Hierzu
stellte er Fallbeispiele mit Patienten aus unterschiedlichen Altersgruppen vor. „Wie auch
in der EXIST-3-Studie gezeigt, kann der mTOR-Inhibitor bei Jugendlichen und Erwachsenen
zu einer deutlichen Besserung der Epilepsie führen, selbst dann, wenn – wie so häufig
bei TSC – eine komplexe Krankheitssituation mit z.B. psychiatrischer Komorbidität
vorliegt.“
Abb. 1: Mittlere prozentuale Veränderung der Anfallshäufigkeit gegenüber dem Ausgangswert
Abbildung modifiziert nach French J et al. 2016 [2].
Weitere Informationen finden Sie unter www.leben-mit-tsc.de.
* Votubia® Tabletten zur Herstellung einer Suspension zum Einnehmen
** Pressekonferenz „TSC-assoziierte Epilepsie – Zulassungserweiterung von Everolimus
ermöglicht holistischen Therapieansatz“ am 24.2.2017 in Frankfurt am Main
A TSC: Tuberous Sclerosis Complex
B EXIST: EXamining everolimus In a Study of TSC
C SEGA: Subependymal Giant Cell Astrocytoma
D Votubia® (Everolimus) wird bei Patienten mit subependymalem Riesenzellastrozytom
(SEGA) aufgrund einer Tuberösen Sklerose (TSC) angewendet, die eine therapeutische
Maßnahme benötigen, für die aber ein chirurgischer Eingriff nicht angemessen ist
E Votubia® Tabletten (Everolimus) sind zur Behandlung von erwachsenen Patienten
mit renalem Angiomyolipom assoziiert mit einer Tuberösen Sklerose (TSC) indiziert, bei
denen ein Risiko für Komplikationen vorliegt (aufgrund von Faktoren wie Tumorgröße
oder vorhandenem Aneurysma oder multiplen bzw. beidseitigen Tumoren), die jedoch
nicht unmittelbar operiert werden müssen
F mTOR: mammalian Target Of Rapamycin
G LE: Low Exposure
H HE: High Exposure
I AED: Anti-epileptic drug
Quelle: Novartis Pharma Pressemitteilung „Expertenmeinungen: Viele Patienten
mit TSC-assoziierter Epilepsie können von der erweiterten Zulassung für Votubia®*
(Everolimus) profitieren“, 24.02.2017; Autor: Novartis Pharma GmbH.
Über die EXIST-3-Studie
EXIST-3 ist eine dreiarmige, randomisierte, doppelblinde, Placebo-kontrollierte Phase-III-Studie
zur Wirksamkeit und Sicherheit einer hohen und niedrigen Everolimus-Exposition als begleitende
Therapie für Patienten mit TSC und partiellen Krampfanfällen, die behandlungsresistent sind
(definiert als anhaltende Anfälle trotz mindestens 2 aufeinander-folgenden Behandlungsregimen
mit Antiepileptika als Mono- oder Kombinationstherapie). In die Studie wurden männliche und
weibliche Teilnehmer (im Alter von 2,2 bis 56,3 Jahren) mit klinisch bestätigter TSC eingeschlossen,
die innerhalb der letzten vier Wochen, vor einer zweimonatigen Prä-Randomisierungsphase,
gleichbleibende Dosierungen mit ein bis drei AEDs erhalten hatten [2].
Primäres Studienziel war die Bewertung der Effektivität einer Begleittherapie mit Everolimus
zur Reduktion der Häufigkeit von partiellen epileptischen Anfällen bei Patienten mit TSC,
die mit ein bis drei AEDs behandelt werden, im Placebo-Vergleich. Sekundäre Ziele umfassten
den prozentualen Anteil an Patienten, die im Beobachtungszeitraum anfallsfrei waren bzw.
Veränderungen in der Anfallsfrequenz zeigten.
Die häufigsten, bei ≥10 % der mit Everolimus LE/HE bzw. Placebo behandelten Patienten
auftretenden, unerwünschten Ereignisse aller Grade und Ursachen umfassten
Stomatitis (LE 55% / HE 64% / Placebo 9%), Diarrhoe (LE 17% / HE 22% / Placebo 5%),
Nasopharyngitis (LE 14% / HE 16% / Placebo 16%), Infektionen der oberen
Atemwege (LE 13% / HE 15% / Placebo 13%), Pyrexie (Fieber) (LE 20% / HE 14% / Placebo 5%),
Erbrechen (LE 12% / HE 10% / Placebo 9%), Husten (LE 11% / HE 10 % / Placebo 3%) und
Ausschlag (LE 6% / HE 10% / Placebo 3%). Unerwünschte Ereignisse Grad 3 oder 4 traten
bei 13 (11%) der Patienten in der Placebo-Gruppe, 21 (18%) der LE-Gruppe und 31 (24%)
der HE-Gruppe auf [2].
Über TSC
Die TSC ist eine Multisystemerkrankung, die zu Fehlbildungen und überwiegend gutartigen
Tumoren in nahezu allen Organen führen kann. Typische, mit TSC assoziierte Tumoren
sind subependymale Knötchen im Gehirn, die bereits bei Neugeborenen vorliegen können
(Prävalenz: 80%). Sie entwickeln sich bei 10% bis 15% [6] der Betroffenen zu einem
subependymalen Riesenzellastrozytom (SEGA), einem langsam wachsenden Hirntumor im Bereich
der Foramina Monroi [16]. Ebenfalls charakteristisch für die Erkrankung sind dermatologische
Symptome wie hypomelanotische Flecken und/oder faziale Angiofibrome, die im Laufe der
Pubertät besonders stark hervortreten [17]. Eine besonders typische TSC-assoziierte
Komplikation, die auch schon im Kindes- oder Jugendalter beobachtet werden kann,
ist die Entstehung renaler Angiomyolipome [18]. Mit zunehmendem Lebensalter sind etwa
80% der Patienten mit TSC von diesen Hamartomen der Nieren betroffen. Oft finden
sich mehrere Tumoren in beiden Nieren. Insgesamt stehen zwischen 10% und 20% aller
renalen Angiomyolipome im Zusammenhang mit TSC [19, 20]. Renale Angiomyolipome bestehen aus
vaskulärem Gewebe sowie glatten Muskel- und Fettzellen. Sie können vor allem durch
ihre teilweise erhebliche Größenausdehnung, meist im Erwachsenenalter, klinisch
relevant werden. Das Wachstum dieser Tumoren kann zu schwerwiegenden Komplikationen
wie Retroperitonealhämorrhagien, Aneurysmen und Nierenfunktionsstörungen führen.
Akute renale Blutungen sowie die terminale Niereninsuffizienz zählen zu den häufigsten
Todesursachen bei TSC-Patienten [21].
Heute ist die genetische Ursache der Tumorbildung bei TSC aufgeklärt: Beim überwiegenden
Teil der Betroffenen sind Mutationen innerhalb der Tumorsuppressorgene TSC1 oder TSC2
nachweisbar, die in etwa 30 % der Fälle autosomal-dominat vererbt werden oder – in etwa
70 % der Fälle – spontan in der Embryonalentwicklung auftreten [22]. TSC1 und TSC2 bilden einen
Proteinkomplex, der im gesunden Organismus die Serin/Threonin-Kinase mTOR inhibitorisch
kontrolliert, einen zentralen Regulator von Tumorzellwachstum, -teilung,
-stoffwechsel und Angiogenese 11,12,13,14,15. Durch die Mutation verliert der
TSC1/TSC2-Proteinkomplex seine Fähigkeit, regulierend auf den mTOR-Signalweg
einzuwirken, und es kommt zu einer dauerhaften und übermäßigen Aktivierung dieses
Signalwegs. Aus dieser konstitutiven Aktivierung resultiert ein unkontrolliertes
Zellwachstum und es bilden sich meist benigne Tumoren, z.B. das SEGA im Gehirn
oder Angiomyolipome in den Nieren.
Über Everolimus
In der Europäischen Union (EU) ist Everolimus unter dem Namen Votubia® Tabletten zur
Behandlung von erwachsenen Patienten mit renalem Angiomyolipom assoziiert mit TSC indiziert,
bei denen ein Risiko für Komplikationen vorliegt (aufgrund von Faktoren wie Tumorgröße oder
vorhandenem Aneurysma oder multiplen bzw. beidseitigen Tumoren), die jedoch nicht unmittelbar
operiert werden müssen 1,4. Die Evidenz basiert auf der Analyse der Veränderung des gesamten
Angiomyolipomvolumens. Zusätzlich werden Votubia® Tabletten und Tabletten zur Herstellung
einer Suspension in der EU bei Patienten mit SEGA aufgrund einer TSC angewendet, die eine
therapeutische Maßnahme benötigen, für die aber ein chirurgischer Eingriff nicht angemessen
ist. Der Nachweis beruht auf der Auswertung der Veränderung des SEGA-Volumens. Ein weiterer
klinischer Nutzen, wie eine Verbesserung der krankheitsbedingten Symptome, wurde nicht gezeigt [1,4].
Everolimus ist zugelassen in 99 Ländern, darunter die USA und die gesamte EU, zur Behandlung
von inoperablen oder metastasierten, gut oder mäßig differenzierten neuroendokrinen Tumoren
pankreatischen Ursprungs bei Erwachsenen mit progressiver Erkrankung sowie zur Therapie von
nicht-resezierbaren oder metastasierten, gut differenzierten, nicht-funktionellen neuroendokrinen
Tumoren des Gastrointestinaltrakts (GI-Trakts) oder der Lunge mit fortgeschrittener Erkrankung.
In mehr als 120 Ländern, darunter die USA und EU, ist Everolimus zugelassen zur Behandlung
von Patienten mit fortgeschrittenem Nierenzellkarzinom, bei denen es während oder nach einer
gegen VEGF gerichteten Therapie zu einer Krankheitsprogression kommt [23].
Darüber hinaus ist der Wirkstoff in 102 Ländern, darunter die USA und EU, in Kombination
mit Exemestan zugelassen zur Therapie des Hormonrezeptor-positiven, HER2/neu-negativen,
fortgeschrittenen Mammakarzinoms bei postmenopausalen Frauen ohne symptomatische viszerale
Metastasierung, nachdem es zu einem Rezidiv oder einer Progression nach einem nicht-steroidalen
Aromataseinhibitor gekommen ist [23].
Referenzen:
[1] Fachinformation Votubia® Tabletten zur Herstellung einer Suspension zum Einnehmen; Stand: Januar 2017.
[2] French JA, et al.: Adjunctive everolimus therapy for treatment-resistant focal-onset seizures 1
associated with tuberous sclerosis (EXIST-3): a phase 3, randomised, double-blind, placebo-controlled trial.
Lancet 2016; 388:2153–2163.
[3] Fachinformation Votubia® Tabletten, Stand: Januar 2017.
[4] Budde K und Gaedeke J: Tuberous sclerosis complex-associated angiomyolipomas: focus on mTOR
inhibition. American Journal of Kidney Diseases. 2012:276–283.
[5] Orlova KA und Crino PB: The tuberous sclerosis complex. Ann NY Acad Sci 2010; 1184:87–105.
[6] Northrup H und Krueger DA: International Tuberous Sclerosis Complex Consensus Group.
Tuberous Sclerosis Complex diagnostic criteria update: Recommendations of the 2012 International
Tuberous Sclerosis Complex Consensus Conference. Pediatr Neurol 2013; 49:243–254.
[7] Webb DW, et al. Morbidity associated with tuberous sclerosis: a population study.
Dev Med Child Neurol 1996; 38: 146–155.
[8] Joinson C, et al.: Learning disability and epilepsy in an epidemiological sample of
individuals with tuberous sclerosis complex. Psychol Med 2003; 33:335–344.
[9] Wohlrab G. Tuberöse Sklerose-Komplex (TSC) – Epilepsie im Kindesalter: ein kurzer Überblick,
Epileptologie 2013; 30:14–21
[10] Chu-Shore CJ, et al.: The natural history of epilepsy in tuberous sclerosis complex.
Epilepsia. 2010: 51:1236–1241.
[11] Krueger DA und Franz DN: Current management of tuberous sclerosis complex. Paediatr Drugs 2008; 10:299–313.
[12] Inoki K, et al.: TSC2 is phosphorylated and inhibited by Akt and suppresses
mTOR signalling. Nat Cell Biol 2002; 4:648–657.
[13] Jaeschke A, et al.: Tuberous sclerosis complex tumor suppressor-mediated S6 kinase
inhibition by phosphatidylinositide-3-OH kinase is mTOR independent. J Cell Biol 2002; 159:217–224.
[14] Dan HC, et al.: Phosphatidylinositol 3-kinase/Akt pathway regulates tuberous sclerosis
tumor suppressor complex by phosphorylation of tuberin. Biol Chem 2002; 277:35364–35370.
[15] Tee AR, et al.: Tuberous sclerosis complex-1 and -2 gene products function together
to inhibit mammalian target of rapamycin (mTOR)-mediated downstream signaling. Proc Natl Acad Sci 2002; 99:13571–13576.
[16] Crino PB, et al.: The tuberous sclerosis complex. N Engl J Med 2006; 355:1345–1356.
[17] Lagos JC und Gomez MR: Tuberous sclerosis: reappraisal of a clinical entity. Mayo Clin Proc 1967; 42:26–49.
[18] Moss J, et al.: Prevalence and clinical characteristics of lymphangioleiomyomatosis (LAM)
in patients with tuberous sclerosis complex. Am J Respir Crit Care Med. 2001; 164:669–671.
[19] Koo KC, et al.: Trends of presentation and clinical outcome of treated renal angiomyolipoma.
Yonsei Med J 2010; 51:728–734.
[20] Steiner MS, et al.: The natural history of renal angiomyolipoma. J Urol 1993; 150:1782–1786.
[21] Shepherd CW, et al.: Causes of death in patients with tuberous sclerosis. Mayo Clin Proc 1991; 66:792–796.
[22] Franz DN, et al.: Efficacy and safety of everolimus for subependymal giant cell astrocytomas
associated with tuberous sclerosis complex (EXIST-1): a multicentre, randomised, placebo-controlled
phase 3 trial. Lancet 2013; 381:125–132.
[23] Fachinformation Afinitor®, Stand: Mai 2016.
| Februar 2017 |
Warning: include(../cols3/aa_meldungen.php): failed to open stream: No such file or directory in /var/www/web383/html/uros/meldungen/aa_2017_votubia.php on line 318
Warning: include(../cols3/aa_meldungen.php): failed to open stream: No such file or directory in /var/www/web383/html/uros/meldungen/aa_2017_votubia.php on line 318
Warning: include(): Failed opening '../cols3/aa_meldungen.php' for inclusion (include_path='.:/opt/php/5.4.45/share/pear:/usr/share/pear') in /var/www/web383/html/uros/meldungen/aa_2017_votubia.php on line 318
© 2003-2024 pro-anima medizin medien
–
impressum
–
mediadaten
–
konzeption
–
datenschutz