Jevtana® – Erste zugelassene Second-line-Therapie nach Docetaxel
Seit dem 17. März 2011 ist Cabazitaxel (Jevtana®) in Kombination mit Prednison
für die Zweitlinientherapie von Patienten mit metastasiertem hormonrefraktärem Prostatakarzinom
(mHRPC) auch in Europa zugelassen. Cabazitaxel schließt eine therapeutische Lücke, die für
Patienten bestand, deren Tumor auf die First-line-
Bislang konnten Patienten mit mHRPC, die auf die First-line-Therapie mit Docetaxel/Prednison nicht
mehr adäquat ansprechen, mit keiner zugelassenen Second-line-Therapie weiterbehandelt werden. In
den meisten Fällen erhielten die Männer Mitoxantron/Prednison (MP), das allerdings keine Zulassung
in der 2nd-line-Therapie besitzt. Hierunter konnten die Schmerzkontrolle und die Lebensqualität
zwar signifikant verbessert werden, doch es resultierte kein Überlebensvorteil.
Bereits im Sommer 2010 wurde Cabazitaxel in den USA in einem beschleunigten Zulassungsprüfverfahren
(fast track) innerhalb von nur elf Wochen für die Zweitlinientherapie zugelassen. Die EMA hat nun
am 17. März 2011 die Zulassung für Europa erteilt. Die Europäische Gesellschaft für Urologie (EAU)
empfiehlt Jevtana® in ihren Therapierichtlinien als Zweitlinientherapie nach Docetaxel-Versagen
mit dem Evidenzlevel A.
An der multizentrischen, randomisierten Phase-III-Zulassungsstudie waren 755 Patienten
mit mHRPC beteiligt, deren Erkrankung nach einer Docetaxel-basierten Chemotherapie fortgeschritten
war. Primärer Endpunkt der Studie war das Gesamtüberleben. Die sekundären Endpunkte umfassten
progressionsfreies Überleben, Tumoransprechrate, Tumorprogression, PSA-Ansprechen, PSA-Progression,
Schmerzansprechen und Schmerzprogression.
Die Patienten erhielten randomisiert Cabazitaxel plus Prednison (n=378) oder Mitoxantron plus
Prednison (n=377). Beide Therapieregime wurden über maximal zehn Zyklen durchgeführt, um einer
Mitoxantron-
Nach einer medianen Nachbeobachtungszeit von 12,8 Monaten lag das relative Sterberisiko im
Cabazitaxel-Arm statistisch signifikant um 30% (Hazard Ratio 0,70; p<0,0001) unter dem im
Trotz der Vorbehandlung mit Docetaxel wurde Jevtana® von den Patienten insgesamt gut vertragen.
Besondere Aufmerksamkeit sollte den von Taxanen bekannten hämatologischen Nebenwirkungen gelten.
Eine febrile Neutropenie dritten oder vierten Grades wurde bei 7,5% der Patienten beobachtet.
Wird explizit auf diese potenziell ernsthafte Komplikation geachtet, ist sie adäquat beherrschbar.
Schwere (Grad 3-4) nicht-hämatologische Nebenwirkungen waren selten: Durchfall trat bei 6,2%,
Übelkeit bei 1,9% und Erbrechen bei 1,9% der Patienten auf.
Quelle: Fach-Pressekonferenz „Die Krebstherapie verändern: Jevtana®- Neuzulassung beim
metastasierten hormonrefraktären/ kastrationsresistenten Prostatakarzinom“ am 22. Februar 2011
in Berlin. Veranstalter: Sanofi-Aventis Deutschland GmbH.
EAU-Empfehlung mit Evidenzlevel A
TROPIC-Studie – Erstmals Überlebensvorteil durch Zweitlinientherapie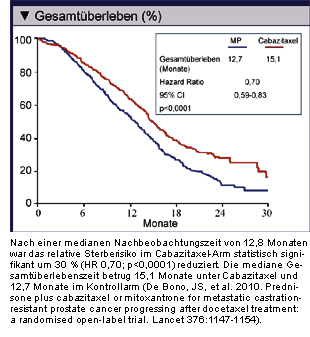
Verträglichkeit
Malgorzata Klafke
Druckversion (pdf)
© 2003-2024 pro-anima medizin medien
–
impressum
–
mediadaten
–
konzeption
–
datenschutz