

Operative Therapie bei Patienten im fortgeschrittenen Alter
Zystektomie ist in der Therapie des muskelinvasiven Urothelkarzinoms der Harnblase der Goldstandard.
Weil Harnblasenkarzinom altersabhängig ist (das mittlere Erkrankungsalter liegt bei 69 Jahren für
Manner und bei 73,4 Jahren für Frauen), weisen Patienten eine hohe Anzahl an Komorbiditäten auf.
Durch strenge Indikationsstellung mit Abschätzung des anästhesiologischen Risikos, der geschätzten
Lebenserwartung (mindestens zwei Jahre), einem verbesserten peri-operativen Management und der
Optimierung der Operationstechnik ist Zystektomie auch bei älteren Patienten sicher durchführbar.
Die Entscheidung welche Operationstechnik und Harnableitung gewählt wird, sollte sich an den medizinischen
Variablen und am Wunsch des Patienten, orientieren. Es besteht eine Tendenz zur inkontinenten Harnableitung
bei älteren Patienten, wobei die Ureterokutaneostomie bei multimorbiden Patienten und beim palliativen
Ansatz auch altersunabhängig eine mögliche Therapievariante darstellt.
Bezüglich des Ausmaßes der Lymph-adenektomie ist die Datenlage bei älteren Patienten weiterhin unklar,
sollte aber wie in der Kohorte jüngerer Patienten abhängig vom onkologischen Ausgangspunkt realisiert
werden.
Die Studienlage zur roboterassistierten Zystektomie bei Patienten im fortgeschrittenen Alter ist noch
unzureichend, aber die Mortalitäts- und Komplikationsraten sind im Vergleich zur offenen Zystektomie
ähnlich. Der Krankenhausaufenthalt ist nach der da-Vinci-Zystektomie mit extrakorporaler Harnableitung
kürzer, die postoperative Rekonvaleszenz erfolgt vermutlich schneller und die postoperativen Schmerzen
sind geringer.
Der Einsatz des Roboters zur radikalen Zystektomie kann möglicherweise die operative Ergebnisqualität
weiter verbessern. Mit einer weiteren Verbreitung der roboterassistierten radikalen Zystektomie,
besonders an Zentren mit entsprechendem Schwerpunkt, ist zu rechnen.
Unabhängig vom operativen Vorgehen bleibt die radikale Zystektomie ein Verfahren mit hoher peri- und
postoperativer Komplikationsrate. Diese scheint sich auch bei über 70-jährigen Patienten nicht
wesentlich von jüngeren Patienten zu unterscheiden.
Im Zuge des demographischen Wandels sehen wir uns auch in der Urologie den Herausforderungen einer alternden
Gesellschaft und der damit einhergehenden Multimorbidität konfrontiert. Die Lebenserwartung in den Industriestaaten
der westlichen Welt nimmt stets zu. Laut Statistischem Bundesamt (Zahlen für Nordrhein-Westfalen) betrug diese
im Jahr 2011 bei neugeborenen Jungen 77 Jahre und 4 Monate (1988: 71 Jahre und 7 Monate), bei neugeborenen Mädchen
lag die Lebenserwartung bei 82 Jahren und 2 Monaten (1988: 78 Jahre und 5 Monate). Ein besonderes Augenmerk richtet
sich bei der erhöhten Lebenserwartung auch auf die mit dem zunehmenden Lebensalter ansteigende Inzidenz der
Karzinomerkrankungen.
-
Das Urothelkarzinom der Harnblase hat einem Altersgipfel bei Patienten zwischen dem 70. und 80. Lebensjahr
und Männer sind mehr als doppelt so häufig betroffen als Frauen. Ca. 30% der Patienten erkranken an einem
muskelinvasiven Tumor, welcher in der Regel die radikale Zystektomie (RC) erfordert.
Dieses Verfahren stellt nach wie vor den Goldstandard bei der Therapie des muskelinvasiven Blasenkarzinoms
dar [1, 2]. Durch Fortschritte im prä- und perioperativen Management ist dieser Eingriff
auch beim älteren Patienten indiziert [3]. Wegen der ebenfalls altersabhängigen Zunahme von
Komorbiditäten muss allerdings intensiv die Frage nach der optimalen Harnableitung und Operationstechnik mit
dem Risikopatienten und dessen Familie intensiv diskutiert werden. In diesem Artikel werden die unterschiedlichen
Aspekte und Verfahren der radikalen Zystektomie im Alter erläutert.
-
Neben der Bewertung der Zystektomie bei einem Patienten im fortgeschrittenen Alter als kurativen oder
palliativen Ansatz sollte nach exakter Indikationsstellung die Entscheidung zur Art der Harnableitung
getroffen werden. Wir müssen uns hierbei zwischen komplexem orthotopen Harnblasenersatz mit Neoblase,
dem Urostoma mit Dünndarminterponat und der Ureterokutaneostomie entscheiden [4, 5].
Die Wahl der Harnableitung sollte individuell an die Grunderkrankung, an Komorbiditäten, das Alter des
Patienten, das anästhesiologische Risiko und an die geschätzte Lebenserwartung und -qualität angepasst
werden. Während man bei jüngeren Patienten in gutem Allgemeinzustand trotz fortgeschrittener Tumorerkrankung
einen kontinenten Harnblasenersatz anbietet, wird man hingegen bei älteren Patienten in schlechtem
Allgemeinzustand oder mit entsprechender kardialer oder pulmonaler Belastung auch nach kurativer
Tumorresektion eher eine einfache Form der Harnableitung ohne Darmsegmente in Erwägung ziehen.
In den vergangenen 25 Jahren hat sich der orthotope Harnblasenersatz von einem experimentellen Ansatz
zum bevorzugten Therapiestandard für beide Geschlechter entwickelt [6].
Auch bei Patienten über 75 Jahre ist die Zystektomie mit einer Mortalitätsrate von weniger als 4,5% und
einer Gesamtkomplikationsrate von etwa 10–50% verbunden; damit ist die Nebenwirkungsrate vergleichbar
mit der Rate bei jüngeren Patienten [7]. Das mittlere Gesamtüberleben nach Zystektomie weist bei Patienten
über 75 Jahren mehr als zwei Jahre auf und liegt nach fünf Jahren zwischen 37–68%.
-
Die Indikation zur radikalen Zystektomie ist abhängig vom Allgemeinzustand des Patienten und den zu erwartenden
Komplikationen durch das Urothelkarzinom. Auch beim älteren Patienten steht die komplette Tumorresektion im Vordergrund.
Die Sanierung zusätzlicher, durch die Tumorerkrankung verursachter Symptome wie Makrohämaturie oder Harnblasentamponade,
Obstruktion, Algurie und allgemeine Schmerzen ist dabei ein sekundäres Ziel [8].
Nebenerscheinungen wie Dysurie, rezidivierende Makrohämaturien, Schmerzen und Anstieg der Retentionsparameter mit Symptomen wie Übelkeit, Erbrechen, Appetitlosigkeit ergeben die Indikation zu einer Harn-ableitung auch in einer palliativen Situation. Liegen weitere Komplikationen wie Fisteln vom Harntrakt zum Darm, der Haut oder Vagina vor, ist bei eindeutiger, auch sozialer, Einschränkung des Patienten eine Harn-ableitung anzustreben.
 Mehr als das Alter des Patienten ist die Evaluation der Summe der Begleiterkrankungen für die Einschätzung der
Therapiefähigkeit und somit Operabilität wichtig. Hierfür gibt es verschiedene Berechnungsinstrumente. Ein
gebräuchlicher Score ist der Charlson-Komorbiditätsindex (Tab.). Dieser Index wurde in verschiedenen Studien zur
Einschätzung der Komorbiditätssituation geriatrischer Patienten verwendet. Er beinhaltet eine Liste von 19 Erkrankungen,
welche je nach Schweregrad mit 1–6 Punkten beurteilt werden können. Diese Erkrankungen haben die Gemeinsamkeit,
dass sie die Einjahresmortalität um den Faktor 1,2 erhöhen.
Mehr als das Alter des Patienten ist die Evaluation der Summe der Begleiterkrankungen für die Einschätzung der
Therapiefähigkeit und somit Operabilität wichtig. Hierfür gibt es verschiedene Berechnungsinstrumente. Ein
gebräuchlicher Score ist der Charlson-Komorbiditätsindex (Tab.). Dieser Index wurde in verschiedenen Studien zur
Einschätzung der Komorbiditätssituation geriatrischer Patienten verwendet. Er beinhaltet eine Liste von 19 Erkrankungen,
welche je nach Schweregrad mit 1–6 Punkten beurteilt werden können. Diese Erkrankungen haben die Gemeinsamkeit,
dass sie die Einjahresmortalität um den Faktor 1,2 erhöhen.
Zudem erfolgt immer nach Begutachtung des Allgemeinzustandes die anästhesiologische Risikostratifizierung unter Zuhilfenahme des ASA-Status („American Society of Anesthesiologists Physical Status Classification”) [9]. Auch der Karnofsky-Index kann für die Entscheidungsfindung hilfreich sein.
Durch ein standardisiertes peri-operatives Management können somit auch Patienten mit einem ASA-Status von 3 und über 75 Jahren operiert werden und dabei gute Resultate erzielt werden. Dies ist mit den Ergebnissen eines jüngeren Patientenkollektives durchaus vergleichbar [10]. Ein höherer ASA-Status korreliert auch mit einer höheren Morbidität und der Zahl der stationären Wiederaufnahmen.
Höheres Alter ist auf der einen Seite mit einer erhöhten tumorspezifischen Mortalität assoziiert [11], auf
der anderen Seite lässt sich bei den über 80-Jährigen mittels Zystektomie die größte Reduktion der Sterberate erreichen [12].
-
Bei der Vielzahl an Möglichkeiten der Harnableitung werden wir auf drei häufige Varianten, die Ureterkutaneostomie, das Ileum
conduit als nicht kontinentes und die Neoblase als kontinentes Harnblasenersatzverfahren genauer eingehen.
Ureterkutaneostomie
Bei zunehmendem Alter wird bei Patienten häufiger die Ureterokutaneostomie (UC) als Harnableitung gewählt.
Sie ist die einfachere Form der operativen Sanierung des muskelinvasiven Urothelkarzinoms und sollte vornehmlich als
palliativer Ansatz bei deutlich fortgeschrittenem Tumorstadium oder kurativ bei alten und oder multimorbiden Patienten,
bei denen die Verwendung von Darmsegmenten für die Harnableitung als zu riskant erscheint, angewendet werden.
Die operative Technik ist überschaubar. Bei regelrechter Konfiguration der Nieren und des ableitenden Systems werden die Harnleiter auf der jeweils ipsilateralen Seite an der Oberfläche der Abdominalwand ausgeleitet. Bei der Transureterokutaneostomie (TUUC) wird ein retroperitoneal mobilisierter Ureter oberhalb der A. mesenterica inferior über den großen Gefäßen unter dem Sigma entlang geführt und End-zu-Seit mit dem anderen Ureter anastomosiert und dieser Ureter als Stoma in die Abdominalwand eingenäht. Vorteil dieser Verfahren ist die kürzere OP-Zeit und damit verbunden geringeres OP-Risiko für den Patienten. Nachteilig ist die hohe Stenosierungsrate der Ureterokutaneostomie. Dies wiederum bietet Potenzial für weitere Komplikationen, wie aszendierende Harnwergsinfektionen, die bei Rezidiven längerfristig zu einer Einschränkungen der Nierenfunktion führen können.
Ileum conduit
Auch die Harnableitung mittels Ileum conduit (Abb. 1 + Abb. 2) gilt als typisches Verfahren bei
älteren weiblichen und männlichen Patienten.
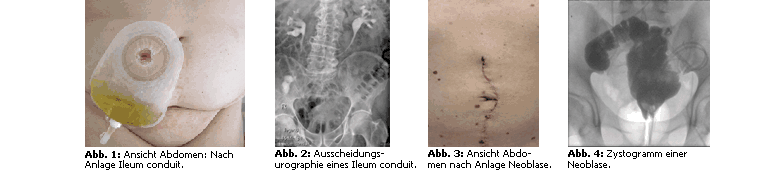
Bei dieser Stomaart reseziert man ein 12–15 cm langes Ileumteilstück, wobei beide Harnleiter auf der oralen Seite
des ausgeschalteten Darmanteiles eingenäht werden. Das andere Ende wird als Stoma im Bereich des Unterbauches ausgeleitet
und geringgradig prominent über Hautniveau fixiert. Im Vergleich zur Ureterhautfistel entwickeln sich langfristig seltener
Strikturen im distalen Harnleitereinpflanzungsbereich. Somit ist in der Mehrzahl keine zusätzliche Harnleiterschienung mit
konsekutiv regelmäßigen Wechseln notwendig.
Mögliche Komplikationen sind Stomaretraktion, -prolaps und Herniationen.
Ileumneoblase
Die Ileumneoblase (Abb. 3 + Abb. 4) ist eine Ersatzblase mit Verbindung zur Harnröhre. Sie kommt den
Eigenschaften hinsichtlich Speicher- und Entleerungsfunktion der natürlichen Harnblase am nächsten. Ziele der orthotopen
Ileumneoblase sind neben dem Erhalt der Nierenfunktion ein optimales kosmetisches Ergebnis sowie die Vermeidung einer
eventuellen Stigmatisierung durch ein Stoma. Die Frühkomplikationen des orthotopen Blasenersatzes sind eine Mortalität
in den ersten 30 Tage von 1–3% und eine prolongierte Darmatonie bis hin zum paralytischen Ileus in bis zu 5% der Fälle.
Bei älteren Patienten, vor allem mit eingeschränkter Nierenfunktion, kann sich eine metabolische Azidose entwickeln.
Kontraindikationen zum orthotopen Blasenersatz mit einer Ileumneo-blase bei älteren Patienten sind eine reduzierte Nierenfunktion (Kreatinin 200 umol/l) sowie eine klinisch relevante zerebrovaskuläre Insuffizienz, die die Wiedererlangung einer zufriedenstellenden Kontinenz schwierig bis unmöglich machen. Aufgrund der Risiken und der fraglichen funktionellen Ergebnisse des orthotopen Blasenersatzes bei Patienten über 75 Jahre ist auf eine strenge Indikationsstellung für diese Operationstechnik zu achten.
Allgemein wird die extendierte Lymphadenektomie (Lymphknoten der Regionen Vasa iliaka externa, interna und kommunis
sowie der Fossa obturatoria) während der RC propagiert. Ob diese ebenso bei der Gruppe älterer Patienten einen Überlebensvorteil
bringt, ist noch ungeklärt. Die SEER (Surveillance, Epidemiology, and End Results Program)-Studie konnte zeigen, dass das
tumorspezifische Gesamtüberleben bei Patienten mit pelviner Lymphadenektomie signifikant höher war als in der Kohorte ohne
Lymphadenektomie.
-
Die roboterassistierte radikale Zystektomie (RARC) hat sich in den vergangenen Jahren als ein minimalinvasives
Verfahren etabliert. Wir unterscheiden ein komplett intrakorporales Verfahren, bei dem sowohl der ablative,
als auch der rekonstruktive Teil mit dem da Vinci-System vorgenommen werden, sowie ein geteiltes Vorgehen mit
der roboterassistierten Ablation und der extrakorporalen Rekonstruk-tion für die Harnableitung. Vermehrt werden
Studien mit hohen Fallzahlen für beide OP-Varianten publiziert. In einer Multicenterstudie (97% extrakorporale,
3% intrakorporale Harnableitung) konnten Smith et al. zeigen, dass die Ergebnisse von roboter-
-
Verfasser:
Dr. med. Henrik Zecha, Dr. med. Nina Harke, Dr. med. J.H. Witt
Klinik für Urologie, Kinderurologie und Urolo-gische Onkologie, Prostatazentrum Nordwest, Chefarzt: Dr. med. J.H. Witt, St. Antonius-Hospital,
Akademisches Lehrkrankenhaus der WWU Münster, Möllenweg 22, 48599 Gronau
Email: henrik.zecha@st-antonius-gronau.de
Literatur:
[1] Hautmann RE, et al. 2007. Urinary diversion. Urology 69:17-49. World Health Organization (WHO) Consensus Conference in Bladder Cancer, http://www.ncbi.nlm.nih.gov/pubmed/17280907
[2] Stein JP, Lieskovsky G, Cote R, et al. 2001. Radical cystectomy in the treatment of invasive bladder cancer: long-term results in 1.054 patients. J Clin Oncol 19:666-675.
[3] Miller DC, Taub DA, Dunn RL, et al. 2003. The impact of co-morbid disease on cancer control and survival following radical cystectomy. J Urol 169:105-109. http://www.ncbi.nlm.nih.gov/pubmed/12478114.
[4] Bricker EM. 1950. Bladder substitution after pelvic exenteration. Surg Clin North Am 30:1511-1521 [PubMed].
[5] Montie JE.1997. Ileal conduit diversion after radical cystectomy: pro. Urology 49:659–662.
[6] Hautmann RE. 2001. 15 years experience with the ileal neobladder. What have we learned? Urologe 40:360–367.
[7] Peyromaure M, Guerin F, Debre B, Zerbib M. 2004. Surgical management of infiltrating bladder cancer in elderly patients. Eur Urol 45/2:147-153.
[8] Gschwend JE, Hautmann RE, Volkmer BG. 2004. Quelle: Springer Medizin Verlag DOI: 10.1007/s00120-004-0638-y.
[9] Anonym. 1963. American Society of Anesthesiologists: new classification of physical status. Anesthesiology 24:111-116.
[10] Koch MO, Smith JA Jr. 1996. Influence of patient age and co-morbidity on outcome of a collaborative care pathway after radical prostatectomy and cystoprostatectomy. J Urol 155:1681-1684.
[11] Nielsen ME, Shariat SF, Karakiewicz PI, et al. 2007. Advanced age is associated with poorer bladder cancer-specific survival in patients treated with radical cystectomy. Eur Urol 51(3):699-708 [PubMed] [CrossRef].
[12] Hollenbeck BK, Miller DC, Taub D, et al. 2004. Aggressive treatment for bladder cancer is associated with improved overall survival among patients 80 years old or older. Urology 64:292-297 [PubMed] [CrossRef].
[13] Smith AB, Raynor M, Amling CL, et al. 2012. Multi-institutional analysis of robotic radical cystectomy for bladder cancer: perioperative outcomes and complications in 227 patients. J Laparoendosc Adv Surg Tech A 22:17-21 [PubMed] [CrossRef].
[14] Jonsson MN, Adding LC, Hosseini A, et al. 2011. Robot-assisted radical cystectomy with intracorporeal urinary diversion in patients with transitional cell carcinoma of the bladder. Eur Urol 60:1066-1073 [PubMed] [CrossRef].
[15] Richards KA, Kader AK, Otto R, et al. 2012. Is robot-assisted radical cystectomy justified in the elderly? A comparison of robotic versus open radical cystectomy for bladder cancer in elderly 75 years old. J Endourol 26:1301-1306 [PubMed] [CrossRef].
© 2003-2024 pro-anima medizin medien
–
impressum
–
mediadaten
–
konzeption
–
datenschutz
