Die Androgendeprivationstherapie (ADT) mittels Luteinisierungshormon-Releasing-Hormon
(LHRH)-Agonisten ist heute Standard in der Behandlung des fortgeschrittenen Prostatakarzinoms.
Insgesamt 662 niedergelassene Urologen dokumentierten Daten von 1906 Prostatakarzinom-Patienten,
die sich einer Behandlung mit Eligard® 22,5 mg oder Eligard® 45 mg unterzogen. Als Hauptgrund
für den Einsatz von Eligard® wurde die Indikation fortgeschrittenes Prostatakarzinom genannt (42,1%).
Weitere wesentliche Gründe für den Behandlungsbeginn mit 3- bzw. 6-Monatsdepot Eligard® waren das
Verweigern oder die Nichteignung einer anderen Therapie (20,2%), das Vorliegen von Metastasen (12,5%),
sowie der PSA-Anstieg nach Bestrahlungstherapie (8,1%) .
Die Analysen basieren auf gepoolten Daten von zwei prospektiven, nicht-interventionellen Studien, die
zwischen Januar 2007 und Dezember 2009 in Deutschland durchgeführt worden waren. Von den Männern
unterzogen sich 58,4% der Monotherapie mit Eligard® und 34,3% einer Kombinationstherapie (Eligard®
plus Antiandrogen, Bisphosphonat oder Chemotherapie). In der gesamten Patientenpopulation wurden bei
58,5% der Männer Begleiterkrankungen vorwiegend kardiovaskulärer Art dokumentiert. Bei etwa der
Hälfte der Männer wurde während der Studie die Einnahme von Begleitmedikationen dokumentiert.
Nach 12-monatiger Behandlung mit Eligard® 22,5 mg und Eligard® 45 mg war der mediane PSA-Spiegel
in der Gesamtpopulation von 12,2 ng/ml auf 0,5 ng/ml gesunken (Abb. 1). Bei Patienten ohne
vorausgegangene ADT und bei mit Leuprorelinacetat (Trenantone®) und Goserelin- oder Buserelinacetat
vorbehandelten Patienten war die Reduktion des PSA-Spiegels vergleichbar deutlich (Abb. 2). Das ist
insofern bemerkenswert, als bei ADT-naiven Patienten ein doppelt so hoher Ausgangswert vorlag.
In Subgruppen-analysen von Patienten, die entweder von Leuprorelinacetat Takeda Pharmaceuticals
(Trenantone®) oder Goserelinacetat Astra Zeneca (Zoladex®) vorbehandelt waren und nun Eligard® 22,5 mg
bzw. Eligard® 45 mg als Monotherapie erhielten, sank der mediane PSA-Spiegel um jeweils 96%
von 7,2 ng/ml auf 0,3 ng/ml bzw. um von 7,5 ng/ml auf 0,3 ng/ml.
In den nicht-interventionellen Studien war die Messung des Testosteronspiegels zu irgendeinem
Zeitpunkt im Studienverlauf nicht vorgeschrieben. Sie erfolgte auf freiwilliger Basis bei
weniger als jedem vierten Patienten. Aus den verfügbaren Daten wurde ermittelt, dass sich
der mediane Testosteronspiegel in der gesamten Patientenpopulation nach 12-monatiger
Behandlungsdauer um 90 % von 88,8 ng/dl auf 8,9 ng/dl erniedrigt hatte (Abb. 3). Beim
Vergleich von ADT-naiven mit den mit LHRH-Agonisten vorbehandelten Patienten wurde durchweg
eine Reduktion des Testosteronspiegels auf unter 20 ng/dl registriert (Abb. 4). Dieser Wert
wird von zahlreichen Experten gegenüber der ursprünglichen Definition von 50 ng/dl als eher
geeignetes Kastrationsniveau angesehen. Die Absenkung des Testosteronspiegels auf möglichst
deutlich unter 20 ng/dl hat Priorität, denn zwischen dem Überleben und der bei einer ADT
erreichten Testosteronspiegelabsenkung besteht bei Patienten mit metastasiertem Prostatakarzinom
ein signifikanter Zusammenhang [5].
In der täglichen Praxis bestätigte sich die gute Verträglichkeit der 3- und
6-Monatsdepotformulierungen Leuprorelinacetat wie sie in klinischen Studien bereits
dokumentiert worden ist. Häufigste nicht-schwerwiegende unerwünschte Wirkungen waren
Schmerzen an der Einstichstelle (2,3%) und Hitzewallungen (1,6%). Schwerwiegende
unerwünschte Wirkungen (Tod, kardiovaskuläre Ereignisse, Tumorprogression wie auch
die Notwendigkeit einer radikalen Prostatektomie) standen nur in einem Fall in einem
möglichen kausalen Zusammenhang mit der Eligard®-Behandlung. Zu einem vorzeitigen
Therapieabbruch aufgrund unerwünschter Wirkungen kam es in nur vier Fällen (0,2%).
Als Depotformulierung des LHRH-Agonisten Leuprorelinacetat in einer bio-abbaubaren Polymermatrix
(Atrigel®) bewirkt Eligard® (Astellas Pharma) die lang anhaltende gleichmäßige Freisetzung
des Wirkstoffs nach subkutaner Applikation. Die Ergebnisse verschiedener klinischer Studien
verdeutlichen, dass bei Anwendung der 1- (7,5 mg), 3- (22,5 mg) und 6- (45 mg) Monatsdepots
Eligard® eine signifikante Reduzierung der Testosteron- und PSA-Spiegel erreicht wird [1–3].
Demgegenüber war die Dokumentation von Daten zur Anwendung der Eligard®-Formulierungen
in einer breiten Patientenpopulation bislang auf eine nicht-interventionelle Prüfung
mit Leuprorelinacetat als 6-Monatsdepot bei 1273 Patienten beschränkt [4]. In der
aktuellen Studie sollten Wirksamkeit und Verträglichkeit von Eligard® 22,5 mg und
Eligard® 45 mg auch in der täglichen Praxis geprüft werden. Die Ergebnisse wurden
anlässlich des 4th European Multidisciplinary Meeting on Urological Cancer (EMUC)
vom 16. bis 18. November 2012 in Barcelona präsentiert.
Betreuung durch niedergelassene Urologen über 12 Monate
Reduktion des Serum-PSA-Spiegels
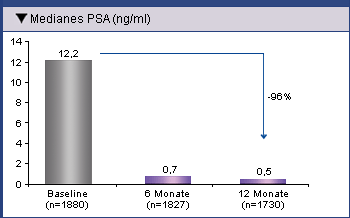
Abb. 1: Absinken des medianen PSA-Spiegels 6 und 12 Monate nach
Behandlung mit 3- oder 6-Monatsdepot Eligard® in der gesamten Patientenpopulation (Ohlmann, et al. 2012).
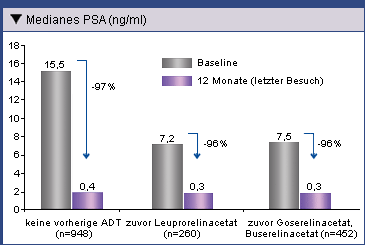
Abb. 2: Reduktion des medianen PSA-Spiegels nach 12-monatiger
Behandlung mit Eligard® 22,5 mg oder Eligard® 45 mg bei ADT-naiven Patienten
und bei mit LHRH-Agonisten vorbehandelten Patienten (Ohlmann, et al. 2012).
Deutlicher Abfall des Testosteronspiegels
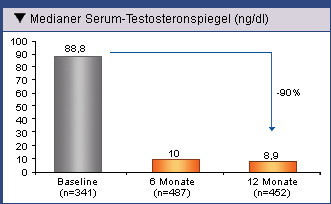
Abb. 3: Mediane Testosteronspiegel in der gesamten
Patientenpopulation 6 und 12 Monate nach Behandlung mit Eligard® 22,5 mg
oder Eligard® 45 mg (Ohlmann, et al. 2012).
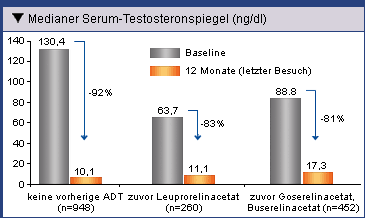
Abb. 4: Reduktion des medianen Testosteronspiegels nach
einer 12-monatigen Behandlung mit Eligard® 22,5 mg und Eligard® 45 mg bei
ADT-naiven Patienten und bei mit LHRH-Agonisten vorbehandelten Patienten (Ohlmann, et al. 2012).
Gute Verträglichkeit von Eligard® bestätigt
Quelle: Ohlmann C-H, Gross-Langenhoff M, Tunn UW. 2012.
Wirksamkeit und Verträglichkeit von 3- und 6-Monatsdepotformulierungen Leuprorelinacetat
bei fortgeschrittenem Prostatakarzinom in der täglichen Praxis: gepoolte Daten aus 2
nicht-interventionellen Studien. 4th European Multidisciplinary Meeting on Urological
Cancer (EMUC) vom 16. bis 18. November 2012 in Barcelona.
Literatur:
[1] Perez-Marreno R, Chu FM, Gleason D, et al. 2002. A six-month, open-label study
assessing a new formulation of leuprolide 7.5 mg for suppression of testosterone in patients with
prostate cancer. Clin Ther. 24:1902-1914.
[2] Chu FM, Jayson M, Dineen MK, et al. 2002. A clinical study of 22.5 mg
La-2550: A new subcutaneous depot delivery system for leuprolide acetate for the treatment
of prostate cancer. J Urol 168:1199-1203.
[3] Crawford ED, Sartor O, Chu F, et al. 2006. A 12-month clinical study
of LA-2585 (45.0 mg): a new 6-month subcutaneous delivery system for leuprolide acetate
for the treatment of proistate cancer. J Urol 175:533-536.
[4] Tunn UW, 2011. A 6-month depot formulation of leuprolide acetate is safe
and effective in daily clinical practice: a noninterventional prospective study in 1273
patients. BMC Urol 2011:11-15.
[5] Perachino M, Cavalli V, Bravi F, 2010. Testosterone levels in
patients with metastatic prostate cancer treated with luteinizing hormone-releasing
hormone therapy: prognostic significance? BJU Int 105:648-651.
© 2003-2024 pro-anima medizin medien
–
impressum
–
mediadaten
–
konzeption
–
datenschutz