Cabozantinib ist überzeugende Option für die Zweitlinie
Mit der Einführung der VEGF-gerichteten Tyrosinkinaseinhibitoren (TKIs) änderte sich
2006 die Therapie des fortgeschrittenen Nierenzellkarzinoms (mRCC) und damit verbesserte
sich auch die Prognose für die Patienten. Heute werden in der Erstlinie bei metastasierter
Erkrankung die TKIs Sunitinib und Pazopanib standardmäßig eingesetzt. Für die
Zweitlinientherapie wurden 2016 drei neue Wirkstoffe für die Behandlung nach TKI-Versagen
zugelassen, die im Vergleich zum bisherigen Standard Everolimus eine überlegene Wirksamkeit
zeigen konnten. Cabozantinib (Cabometyx®) ist darunter die einzige Monosubstanz, die in
einer Phase-III-Studie in allen Wirksamkeitsendpunkten – Gesamtüberleben (OS),
progressionsfreies Überleben (PFS) und objektive Ansprechrate – statistisch signifikante
Vorteile bei vorbehandelten Patienten mit fortgeschrittenem Nierenzellkarzinom zeigte.
Die aktuellen Therapieentwicklungen beim Nierenzellkarzinom waren Inhalt des Satellitensymposiums
der Firma Ipsen im Rahmen der EAU-Jahrestagung in London.
Zwei weiterentwickelte Tyrosinkinaseinhibitoren und eine Immuntherapie stehen nun für
die Behandlung nach VEGF-TKI-Versagen zur Verfügung: Cabozantinib verringerte in der
Phase-III-Studie METEOR das Risiko eines Progresses (PFS, primärer Endpunkt) um 49% und
das Risiko zu Versterben um 34% [1]. Lenvatinib zeigte sich in Kombination mit Everolimus
in einer Phase-II-Studie der alleinigen Everolimus-Therapie bezüglich des PFS überlegen [2].
Der Checkpoint-Inhibitor Nivolumab erreichte in der Phase-III-Studie CheckMate 025 den
primären Endpunkt, eine Verlängerung des Gesamtüberlebens [3].
Cabozantinib ist ein Multi-Target-Kinase-Inhibitor (MTKI), der zusätzlich zu VEGF auch
MET und AXL inhibiert und damit die Resistenz gegenüber den etablierten TKIs überwinden
kann, erklärte Susanne Osanto, Leiden University Medical Center, Leiden/Niederlande. In
der randomisierten, offenen Phase-III-Studie METEOR erhielten 658 Patienten, die nach
VEGF-gezielter Therapie progredient waren, täglich 60 mg Cabozantinib oder 10 mg Everolimus.
Der primäre Endpunkt, eine Verlängerung des PFS, wurde erreicht: Im Median lebten die
Patienten im Cabozantinib-Arm 7,4 Monate und im Everolimus-Arm 3,9 Monate progressionsfrei
(HR=0,51; p<0,0001). Das Gesamtüberleben (OS) betrug median 21,4 versus 16,5 Monate
(HR=0,66; p=0,00026)
Die Nebenwirkungen unter Cabozantinib waren die typischen unerwünschten Wirkungen bei
der Behandlung mit einem VEGF-TKI. Bei 62% bzw. 25% der Patienten im Cabozantinib- bzw.
Everolimus-Arm wurden Dosisreduktionen berichtet. Die Therapie brachen Patienten mit 12%
und 11% in beiden Studienarmen vergleichbar oft ab.
In ihren Leitlinien für die systemische Therapie des metastasierten klarzelligen
Nierenzellkarzinoms in der Version von 2016 empfiehlt die EAU für die Zweitlinie nach
Anti-VEGF-Therapie basierend auf dem OS-Erfolg Cabozantinib oder Nivolumab sowie basierend
auf den PFS-Daten Axitinib, Sorafenib oder Everolimus [5]. In der dritten Therapielinie
bleiben nach VEGF-gerichteter Therapie (±Nivolumab) entsprechend der Vortherapien Nivolumab,
Cabozantinib oder Everolimus.
Zusammenfassend erklärte Osanto, dass zielgerichtete Therapien die Prognose der
RCC-Patienten über die letzte Dekade signifikant verbessert haben, aber dennoch
die meisten Patienten gegenüber der ersten Therapielinie Resistenzen entwickeln.
Die neuen Zweitliniensubstanzen zeigen einen Überlebensbenefit nach Resistenz gegenüber
der Erstlinientherapie, welches zur Zulassung von drei neuen Substanzen im Jahr 2016 führte.
Diese Entwicklung wurde in den Leitlinien aufgenommen. Die Selektion der geeigneten
Zweitlinientherapie für den individuellen Patienten sei eine Herausforderung, so Osanto,
die derzeit nur über die Parametern MET/AXL/VEGFR-Blockade versus immunonkologische
Therapie, oral versus intravenös und den Tumor- sowie Patientencharakteristiken entschieden
werden könne.
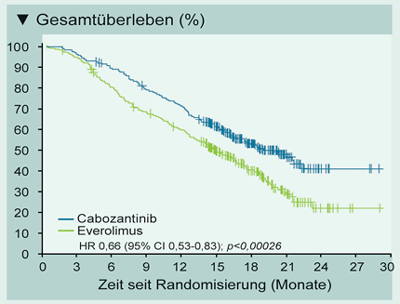
Abb.: METEOR - Gesamtüberleben unter Cabozantinib versus Everolimus nach
TKI-Versagen (mod. nach [4])
Bericht: Dr. Ine Schmale, Westerburg
Literatur:
[1] Choueiri TK, et al. 2015. N Engl J Med 373:1814-1823
[2] Motzer RJ, et al. 2015. Lancet Oncol 16:1473-1482
[3] Motzer RJ, et al. 2015. N Engl J Med 373:1803-1813
[4] Choueiri TK. et al. 2016. Lancet Oncol 17:917-927
[5] EAU Guidelines, Version 2016.
Quelle: Ipsen-Satellitensymposium „Treating urological cancers: New
twists and turns in the road”, im Rahmen des EAU 2017, 25. März 2017, London
© 2003-2024 pro-anima medizin medien
–
impressum
–
mediadaten
–
konzeption
–
datenschutz