Anders als bei metastasiertem Urothelkrebs und metastasiertem Nierenzellkarzinom, bei denen
Immuncheckpoint-Inhibitoren (ICIs), bereits zum etablierten Therapieinstrumentarium gehören,
hat sich die Anwendungsmöglichkeit der ICIs in der Behandlung von Prostatakrebs als deutlich
schwer realisierbar erwiesen. Dennoch hatten erste Pilotstudien und frühe klinische Prüfungen
mit ICIs bei Männern mit kastrationsresistentem Prostatakrebs (CRPC) immerhin Antitumoraktivität
erkennen lassen [1, 2]. Insofern erschien eine Fortführung solcher Studien auf Phase-III-Ebene
gerechtfertigt. Deren Konzeption sah vor, einem Teil der Patienten zusätzlich eine
Strahlentherapie zu verabreichen. Das entsprach präklinischen Indizien, die auf synergistische
Aktivität zwischen Anti-CTLA4-Antikörper- und Strahlentherapie hindeuteten. Als Rationale hierfür
wird eine systemische immunologische Reaktion des Körpers gegen den Tumor (abskopaler Effekt)
diskutiert [2].
Strahlentherapie plus CTLA4-Inhibition bei Patienten mit mCRCP: In einer randomisierten,
Placebo-kontrollierten Phase-III-Studie (CA184-043) waren mCRPC-Patienten mit zumindest einer
Knochenmetastase und Krankheitsprogression nach Docetaxel mit Strahlentherapie und anschließend
mit Ipilimumab behandelt worden. Obwohl der primäre Endpunkt – die Verlängerung des
Gesamtüberlebens (OS) – nicht erreicht worden war, resultierte eine verlängerte
Progressionsfreiheit. Zudem hatten exploratorische Analysen ergeben, dass Patienten
ohne viszerale Metastasen mit Ipilimumb ein längeres OS als mit Placebo erreichten [3].
Nach einem weiteren Jahr Follow-up war die für Ipilimumab plus Strahlentherapie festgestellte
Aktivität erhalten geblieben. Zudem ließen Subgruppenanalysen erkennen, dass Patienten mit
minderer Tumorlast eher von einer Behandlung mit Ipilimumab profitieren könnten [4]. Die
Überprüfung dieses Effektes in einer randomisierten, Placebo-kontrollierten Phase-III-Studie
(CA 184-095) mit Ipilimumab als Erstlinientherapie bei mCRPC-Patienten ohne viszerale
Metastasen und ohne oder mit nur leichten Symptomen, führte allerdings zu keiner Verlängerung
des Überlebens. Wiederum wurde mit Ipilimumab eine längere Progressionsfreiheit als mit
Placebo registriert [5]:
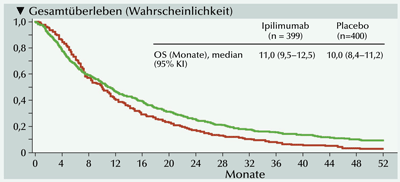
In der im Voraus geplanten langfristigen Analyse der Studie CA184-043 blieb der ab
etwa dem achten Monat eingetretene Überlebensvorteil für Ipilimumab plus Strahlentherapie
gegenüber Placebo plus Strahlentherapie kontinuierlich bestehen (Abb. 1) [6].
Behandlung von mCRPC-Patienten mit Nivolumab plus Ipilimumab: Erste Ergebnisse der Phase-II-Studie
CheckMate 650 lassen erkennen, dass einige Patienten mit metastasiertem Prostatakrebs
nach dem Versagen von Hormon- und Chemotherapie mit der ICI-Kombination Nivolumab plus
Ipilimumab erfolgreich behandelt werden können. Asymptomatische/minimal symptomatische
Patienten mit Progress nach sekundärer Hormonablation ohne Chemotherapie bildeten eine
Kohorte 1 und Patienten mit Progress nach Taxan-basierter Chemotherapie eine Kohorte 2.
Bis zur Interimsanalyse hatten 78 Patienten ein Follow-up von zumindest 6 Monaten. In
den Kohorten 1 und 2 betrug die objektive Ansprechrate der Patienten mit messbarer Krankheit
zu Baseline 26% bzw. 10%. Eine Auswahl der vermutlich auf die Immuntherapie ansprechenden
Patienten könnte sich an folgenden Biomarkern orientieren: Hohe Tumormutationslast, PD-L1 1%,
Defekte der homologen Rekombinationsreparatur und DNA-Schadensreparatur [7].
Pembrolizumab-Monotherapie bei vorbehandelten mCRPC-Patienten: In der Phase-II-Open-label-Studie
(KEYNOTE199) standen die Antitumoraktivität und Sicherheit von Pembrolizumab bei
mCRPC-Patienten an 85 Zentren in 21 Ländern zur Prüfung an. Die Studienpopulation
umfasste drei Kohorten, deren Patienten alle zuvor mit Docetaxel und einer zielgerichteten
endokrinen Therapie behandelt worden waren. Bei den Männern in Kohorte 1 und 2 lag ein
nach RECIST v1.1 messbarer Tumor vor, und es bestand PD-L1-Positivität bzw. PD-L1-Negativität.
In Kohorte 3 lag der Schwerpunkt auf detektierbaren Knochenmetastasen [8].
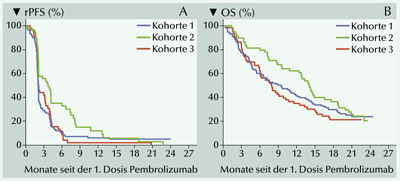
In die Kohorten 1, 2 und 3 wurden 133, 66 bzw. 59 Patienten aufgenommen. Die objektive
Ansprechrate in Kohorte 1 betrug 5% und 3% in Kohorte 2. Als mediane Dauer des Ansprechens
wurden nicht erreicht (Bereich: 1,9 bis 21,8 Monate) bzw. 10,6 Monate (Bereich: 4,4 to 16,8 Monate)
registriert. Die Krankheitskontrollraten beliefen sich auf 10% in Kohorte 1, auf 1,9% in Kohorte 2
und auf 22% in Kohorte 3.
Das mediane Gesamtüberleben in den Kohorten 1–3 erreichte 9,5, 7,9 bzw. 14,1 Monate. Als
medianes radiologisches progressionsfreies Überleben wurden vom zentralen Review für Kohorte 1
und 2 jeweils 2,1 Monate ermittelt. Für Kohorte 3 waren es 3,7 Monate
Mismatch-Reparatur-Defizienz in metastasiertem Prostatakrebs: Auch wenn nicht ausgewählte
mCRPC-Patienten unbefriedigend auf eine Anti-PD1-Therapie ansprechen, sollten Patienten mit
defizienter Mismatch-Reparatur (dMMR) oder hoher Mikrosatelliteninstabilität (MSI-H) darauf
eher positiv ansprechen. Bei der Prostatakrebs-Diagnose sind dMMR-Tumore meist bereits
fortgeschritten und mit einem hohen Gleason-Score assoziiert. Ihr Ansprechverhalten auf
die standardmäßigen therapeutischen Maßnahmen entspricht dem bei nicht ausgewählten Patienten.
Im Gegensatz dazu sprechen dMMR-Tumore deutlich besser auf Immuncheckpoint-Blockade an.
In einer kleinen Studie erhielten 17 mCRPC-Patienten (dMMR/MSI-hoch) Pembrolizumab. Bei
8 Männern kam es zum PSA50-Ansprechen. Das mediane progressionsfreie Überleben nach
6 Monaten betrug 64,1%. Nach einem medianen Follow-up von 12 Monaten (Bereich: 3–20 Monate)
setzten 7 der Patienten mit PSA50-Ansprechen die Behandlung ohne Anzeichen von Progression fort [9].
Prävalenz von Mikrosatelliteninstabilität beim Prostatakrebs: Von 1.346 Prostatakrebs-Patienten,
die sich am Memorial Sloan Kettering Cancer Center behandeln ließen, wurden zwischen
Januar 2015 bis Januar 2018 insgesamt 1.551 Tumore mit einem gezielten Sequenzierungsassay
prospektiv analysiert. Unter 1.033 Patienten deren Tumor eine geeignete Qualität für die
MSI-Sensor-Analyse hatte, waren 32 (3,1%) mit einem MSI-H/dMMR-Prostatakarzinom. In neun
weiteren Fällen lieferte die Analyse kein klares Ergebnis. Sie wies aber Anzeichen einer
dMMR auf [10].
Fünf von elf mCRPC-Patienten, die eine Anti–PD-1/PD-L1-Therapie erhalten hatten,
profitierten von einem anhaltenden klinischen Benefit. Nach Stand vom Mai 2018 wurden 5
der einst 11 Responder über 89 Wochen noch immer weiterbehandelt [10].
jfs
Quelle:
Dezember 2020
Abb. 1: Die Kurven der Kaplan-Meier-Analyse des Gesamtüberlebens (OS)
überkreuzen sich nach 7–8 Monaten. Danach ist die Überlebenswahrscheinlichkeit der Patienten
im Ipilimumab-Arm durchgehend über vier Jahre hinaus günstiger. KI=Konfidenzintervall [6].
(Abb. 2A). Das mediane Gesamtüberleben in den Kohorten 1–3 erreichte 9,5 Monate,
7,9 Monate bzw. 14,1 Monate (Abb. 2B).
Als 12-Monatsraten des Überlebens wurden 41%, 35% bzw. 62% ermittelt [8].
Abb. 2: (A) Kaplan-Meier-Schätzungen des radiographischen progressionsfreien
Überlebens (rPFS) durch ein zentrales Review in den Kohorten 1 (n=133), 2 (n=66) und 3 (n=59).
(B) Kaplan-Meier-Schätzungen des Gesamtüberlebens (OS) in den Kohorten 1, 2 und 3 [8].
[1] Small EJ, Tchekmedyian NS, Rini BI, et al. 2007. A pilot trial of CTLA-4 blockade
with human anti-CTLA-4 in patients with hormone-refractory prostate cancer. Clin Cancer Res 13:1810-1815.
[2] Slovin SF, Higano CS, Hamid O, et al. 2013. Ipilimumab alone or in combination
with radiotherapy in metastatic castration-resistant prostate cancer: results from an open-label,
multicenter phase I/II study. Ann Oncol 24:1813-1821.
[3] Kwon ED, Drake CG, Scher HI, et al. 2014. Ipilimumab versus placebo after radiotherapy
in patients with metastatic castration-resistant prostate cancer that had progressed after
docetaxel chemotherapy (CA184-043): a multicentre, randomised, double-blind, phase 3 trial.
Lancet Oncol 15:700-712.
[4] Fizazi K, Drake CG, Kwon ED, 2014. Updated overall survival (OS) from the phase 3 trial,
CA184-043: ipilimumab (Ipi) vs. placebo (Pbo) in patients with post-docetaxel metastatic
castration-resistant prostate cancer (mCRPC). Ann Oncol 25 (suppl_4):iv259-iv260.
[5] Beer TM, Kwon ED, Drake CG, et al. 2017. Randomized, double-blind, phase III trial
of ipilimumab versus placebo in asymptomatic or minimally symptomatic patients with metastatic
chemotherapy-naive castration-resistant prostate cancer. J Clin Oncol 35:40-47.
[6] Fizazi K, Drake CG, Beer TM, et al. 2020. Final analysis of the ipilimumab
versus placebo following radiotherapy phase III trial in postdocetaxel metastatic
castration-resistant prostate cancer identifies an excess of long-term survivors.
Eur Urol 78 822-830.
[7] Sharma P, Pachynski RK, Narayan V, et al. 2019. Initial results from a
phase II study of nivolumab (NIVO) plus ipilimumab (IPI) for the treatment of metastatic
castration-resistant prostate cancer (mCRPC; CheckMate 650). J Clin Oncol 37(7_suppl):142-142.
[8] Antonarakis ES, Piulats JM, Gross-Goupil M, et al. 2020. Pembrolizumab for
treatment-refractory metastatic castration-resistant prostate cancer: Multicohort,
open-label phase II KEYNOTE-199 study. J Clin Oncol 38:395-405.
[9] Graham LS, Montgomery B, Cheng HH, et al. 2020. Mismatch repair deficiency in
metastatic prostate cancer: Response to PD-1 blockade and standard therapies.
PLoS ONE 15:e0233260.
[10] Abida W, Cheng ML, Armenia J, et al. 2019. Analysis of the prevalence of
microsatellite instability in prostate cancer and response to immune checkpoint
blockade. JAMA Oncol 5:471-478.
© 2003-2024 pro-anima medizin medien
–
impressum
–
mediadaten
–
konzeption
–
datenschutz